
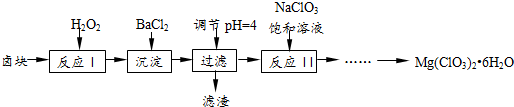
分析 (1)根据沉淀溶解平衡常数Ksp=c(SO42-)•c(Ba2+ )来计算;
(2)在酸性环境下,高猛酸根离子可以将亚铁离子氧化为三价铁离子;
(3)根据高锰酸根离子和亚铁离子的化学方程式,据高锰酸根离子的量来确定亚铁离子的量,根据元素守恒确定样品的组成情况.
解答 解:(1)沉淀溶解平衡常数Ksp=c(SO42-)•c(Ba2+ ),c(Ba2+ )=$\frac{Ksp}{c(S{{O}_{4}}^{2-})}$,当c(SO42-)≤1.0×10-5 mol•L-1,所以溶液中c(Ba2+ )≥1.1×10-5mol/L,故答案为:1.1×10-5;
(2)在酸性环境下,高猛酸根离子可以将亚铁离子氧化为三价铁离子,即MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,当高锰酸钾稍过量时,溶液由无色变为浅紫色;
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;溶液由无色变为浅紫色;
(3)取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660g.根据硫酸根离子守恒,硫酸根离子的物质的量和硫酸钡的物质的量是相等的,即为:$\frac{0.4660g}{233g/mol}$=0.002mol,取25.00mL溶液A,滴加适量稀硫酸,用0.010 0mol•L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL,所以亚铁离子的物质的量为:5×0.01×1×10×10-3=5×10-4mol,根据电荷守恒得:n(Al)=$\frac{1}{3}$[2×0.002mol-2×5.0×10-4]=1×10-3mol,根据质量守恒,水的物质的量:[1.8520g×$\frac{25ml}{100ml}$-5.0×10-4mol×56g/mol-1.0×10-3mol×27g/mol-0.002mol×96g/mol]×$\frac{1}{18}$=1.2×10-2mol,所以x:y:z=1:1:24,化学式为:FeSO4•Al2(SO4)3•24H2O;
答:样品的组成为FeSO4•Al2(SO4)3•24H2O.
点评 本题涉及中和滴定、沉淀溶解平衡以及守恒法来确定物质的分子式等知识的综合考查题,要求学生具有分析和解决问题的能力,以及较强的运算能力,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 Al2(SO4)3 MgCl2 KCl | |
| B. | BaCl2 Na2SO4 (NH4)2SO4 KOH | |
| C. | AgNO3 NaCl KCl CuCl2 | |
| D. | Fe2(SO4)3 NaOH 稀硫酸 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Br-、CO32- | B. | NH4+、I-、SO32- | C. | Fe2+、I-、SO32- | D. | Fe2+、Br-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH变小 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸,c(H+)增大,KW变小 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

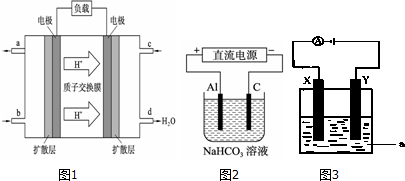
| A. | M是直流电的正极 | B. | 电子流向是N→b→a→M | ||
| C. | 电解过程中,水是氧化剂 | D. | b电极附近溶液的pH变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com