
| A. | 该实验过程中要用到氧化剂 | |
| B. | 检验碘单质是否存在,可用碘化钾溶液 | |
| C. | 要萃取碘水中的碘,可以用汽油或酒精 | |
| D. | 利用如图所示装置不能分离食盐和晶体碘的混和物 |
分析 A.把碘离子转化为单质碘,I元素的化合价会升高;
B.单质碘遇到淀粉溶液会变蓝色;
C.酒精与水互溶,不能作萃取剂;
D.食盐受热不挥发也不分解,单质碘受热易升华.
解答 解:A.把碘离子转化为单质碘,I元素的化合价会升高,所以该实验过程中要用到氧化剂把碘离子氧化为单质碘,故A正确;
B.单质碘遇到淀粉溶液会变蓝色,所以检验碘单质是否存在,可用淀粉溶液,不能用碘化钾溶液,故B错误;
C.酒精与水互溶,不能作萃取剂,所以要萃取碘水中的碘,可以用汽油,但是不能用酒精,故C错误;
D.食盐受热不挥发也不分解,单质碘受热易升华,所以利用如图所示装置能分离食盐和晶体碘的混和物,在盛有冷水的烧瓶的底部接收得到的是单质碘,烧杯中剩余的是食盐,故D错误.
故选A.
点评 本题考查了氧化还原反应、物质的检验、分离提纯的基本操作等,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大,注意把握常见的分离提纯的方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 卤素原子、碳碳双键 | B. | 羟基、羧基 | ||
| C. | 醛基、酯基 | D. | 碳碳双键、酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C | B. | NH3 | C. | Mg | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 3mol•L-1 NaClO3溶液 | B. | 100mL 2mol•L-1 FeCl3溶液 | ||
| C. | 150mL 3mol•L-1 KCl溶液 | D. | 150mL 1mol•L-1 MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一小块钠投入硫酸铜溶液,会析出紫红色的铜 | |
| B. | 将金属钠放置在空气中,最终转化为碳酸钠 | |
| C. | 铁在氧气中燃烧,可以得到红色的三氧化二铁 | |
| D. | 硫在过量的氧气中燃烧,可以得到产物SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
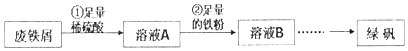
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )
如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )| A. | X和Z氢化物的热稳定性和还原性均依次减弱 | |
| B. | R、W和氢三种元素形成的阴离子有2种以上 | |
| C. | RY2分子中每个原子的最外层均为8电子结构 | |
| D. | R、Y、Z的最高价氧化物对应的水化物的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
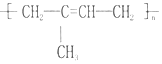 的名称聚2-甲基-1,3-丁二烯,其单体的结构简式CH2═C(CH3)CH═CH2.
的名称聚2-甲基-1,3-丁二烯,其单体的结构简式CH2═C(CH3)CH═CH2.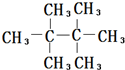 .
. .
.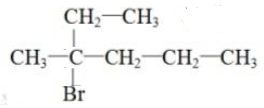 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率增加,逆反应速率减小 | |
| B. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| C. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com