
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如图:
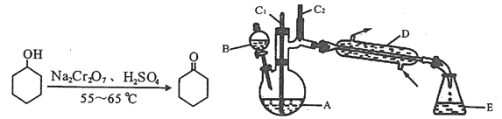
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为__。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①如何滴加酸性Na2Cr2O7溶液___;
②蒸馏不能分离环己酮和水的原因是___。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是___;
②b中水层用乙醚萃取的目的是___;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__,操作d中,加入NaCl固体的作用是__。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环己酮的产率为__。
【答案】冷凝管 打开分液漏斗颈上的玻璃塞,拧开下端的活塞,缓慢滴加 环己酮和水形成具有固定组成的恒沸物一起蒸出 dbeca 使水层中少量的有机物进一步被提取,提高产品的产量 漏斗、分液漏斗 降低环己酮的溶解度,増加水层的密度,有利于分层 60.6%
【解析】
本实验的目的是制备环己酮,装置A中利用酸性Na2Cr2O7溶液将环己醇在55 ~ 65℃时氧化得到环己酮,反应完成后,加入适量水,蒸馏,收集95 ~ 100C的馏分,得到主要含环己酮粗品和水的混合物;之后进行提纯,首先往液体中加入NaCl固体至饱和,从而降低环己酮的溶解度,并且增加水层的密度,静置后分液;分液后水层用乙醚萃取进一步提取水层中环己酮并入有机层;之后用无水硫酸镁除去有机物中少量的水分,过滤后蒸馏分离乙醚,得到纯净的环己酮。
(1)装置D的名称是冷凝管,具有冷凝蒸汽作用;
(2)①由于酸性Na2Cr2O7溶液氧化环己醇反应剧烈,导致体系温度迅速上升、副反应增多,所以酸性Na2Cr2O7溶液加入不能太快,应打开分液漏斗颈上的玻璃塞,拧开下端的活塞,缓慢滴加;
②由于环己酮和水形成具有固定组成的恒沸物,环己酮和水会一起蒸出,导致蒸馏不能分离环己酮和水;
(3)①环己酮的提纯:首先往液体中加入NaCl固体至饱和,从而降低环己酮的溶解度,并且增加水层的密度,静置后分液;分液后水层用乙醚萃取进一步提取水层中环己酮并入有机层;之后用无水硫酸镁除去有机物中少量的水分,过滤后蒸馏分离乙醚,得到纯净的环己酮,所以,提纯步骤的正确顺序是dbeca;
②环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚微溶于水,则乙醚能作萃取剂,能将水中的环己酮萃取到乙醚中,从而提高产品产量;
③过滤需要由漏斗组成的过滤器,分液需要的主要仪器为分液漏斗;NaCl能增加水层的密度,降低环己酮的溶解,有利于分层;
(4) 环己醇的质量为10mL×0.96g/mL=9.6g,理论上得到环己酮质量=![]() ×98g/mol=9.408g,恢复至室温时,分离得到纯产品体积为6mL,由表中的密度可以算出环己酮的实际质量为0.95g/mL×6mL=5.7g,所以环己酮的产率为:
×98g/mol=9.408g,恢复至室温时,分离得到纯产品体积为6mL,由表中的密度可以算出环己酮的实际质量为0.95g/mL×6mL=5.7g,所以环己酮的产率为:![]() =60.6%。
=60.6%。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】海水约占地球总储水量的97%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量氯化钠,氯化钠的电子式为________________,氯化钠中的非金属元素在元素周期表中的位置为第________周期第________族。
(2)目前,国际上广泛应用的海水淡化的主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得到高纯度淡水,由此可判断蒸馏的过程中发生的是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应方程式为________________________,检验阳极产物的方法是________________________。
(4)工业上从海水中提取溴,第一步是将氯气通入富含溴离子的海水中,将溴置换出来;第二步用空气把溴吹出,用SO2的水溶液吸收,使溴转化为氢溴酸;第三步用氯气氧化氢溴酸即得单质溴。写出上述过程中第一、二步发生反应的离子方程式:①______________________;②____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃下,三种硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
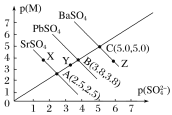
A.溶度积:BaSO4>PbSO4>SrSO4
B.Y点对应的SrSO4是不饱和溶液,能继续溶解SrSO4
C.Z点对应的溶液中c(Ba2+)>c(SO42-),c(Ba2+)·c(SO42-)等于1×10-25
D.BaSO4不可能转化成PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究![]() 和
和![]() 的性质,将两种气体同时通入水中,实验装置如图:
的性质,将两种气体同时通入水中,实验装置如图:
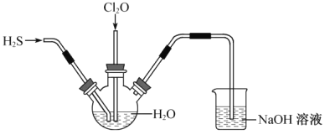
请回答:(1)三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示________。
(2)若通入水中的![]() 已过量,设计实验方案检验________。
已过量,设计实验方案检验________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:

回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,需用到的玻璃仪器有_____;过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是______。
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g2=0.3,溶液体积变化忽略不计)。
(8)写出“高温烧结固相合成”过程的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3 分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 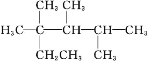 的名称是:2,3,4-三甲基-2-乙基戊烷
的名称是:2,3,4-三甲基-2-乙基戊烷
D.C6H14的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各组物质之间不能通过一步反应实现如图转化的是
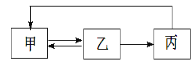
甲 | 乙 | 丙 | |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | NH3 | NO | HNO3 |
C | AlCl3 | Al(OH)3 | Al2O3 |
D | Cl2 | HCl | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图形象地表示了氯化钠的形成过程,下列相关叙述中,不正确的是( )

A. 钠原子易失去一个电子,氯原子易得到一个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D. 氯化钠是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com