
分析 (1)根据方程式计算出辛烷与氧气恰好反应时,辛烷与空气的体积比有最大值;
(2)辛烷与空气体积比<V时,氧气过量,会产生NO、NO2;
(3)CO与NO反应,生成无毒气体为氮气和二氧化碳.
解答 解:(1)由辛烷完全燃烧2C8H18+25O2$\stackrel{点燃}{→}$16CO2+18H2O,则$\frac{V({C}_{8}{H}_{18})}{\frac{1}{5}V(空气)}$=$\frac{2}{25}$,所以,V=$\frac{V(辛烷)}{V(空气)}$=$\frac{2}{25}×\frac{1}{5}$=0.016,故答案为:0.016;
(2)辛烷与空气体积比<V时,氧气过量,在放电条件下,发生反应N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,2NO+O2═2NO2,会产生NO、NO2有毒气体,污染大气,故答案为:NO、NO2;
(3)由信息可知,“催化转换器”使CO与NO反应,生成无毒气体为氮气和二氧化碳,该反应为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
点评 本题考查常见环境污染及治理,为高考常见题型和高频考点,注意信息的抽取和应用是解答本题的关键,侧重学生获取信息并处理信息能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 自然界存在大量硅单质 | |
| B. | 自然界的硅易开采,且可再生 | |
| C. | 硅燃料便于运输、贮存,从安全角度考虑,硅是优质燃料 | |
| D. | 硅燃料燃烧放出的热量多,其燃烧产物对环境的污染容易有效地控制 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
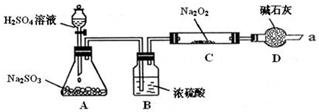

| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.002mol(L•s) | B. | v(H2O)=0.002mol/(L•s) | ||
| C. | v(NO)=0.0015mol/(L•s) | D. | v(O2)=0.00125mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.
A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| C. | 浓度为0.1mol•L-1 的下列溶液,pH由大到小的排列顺序:NaOH>Na2CO3 >(NH4)2SO4 >NaHSO4 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com