
(10分)金属镁是六方最密堆积,金属铜是面心立方最密堆积,下图分别给出它们的堆积状况和晶胞示意图,它们空间利用率相同,假定镁、铜原子均为刚性小球,已知球的半径分别为R1厘米、R2厘米,阿伏伽德罗常数NA
| (1)镁原子在二维空间的配位数为 |
(2)位于晶胞中部的鎂原子与离它最近两平面 (填“相离”或“相切”或”相交”) | |
(3)请用含R1、NA的数学式子表达金属镁的密度: g/cm3(根号带在分子上) | |
| (4)铜原子在三维空间的配位数为 |
(5)晶胞中面心上的六个铜原子构成的空间几何体名称为 | |
(6)请用含R2、NA的数学式子表达金属铜的密度: g/cm3(根号带在分子上) |
科目:高中化学 来源:2014-2015内蒙古北方重工业集团三中高一下学期第一次月考化学试卷(解析版) 题型:选择题
配制250ml 0.1mol/L的NaOH溶液时,下列实验操作会使配得的溶液NaOH物质的量浓度偏大的是
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中进行定容时仰视刻度线
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北宜昌市高二3月月考化学试卷(解析版) 题型:选择题
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,某些反应与平衡常数数值如下:2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是
A.常温下,水分解产生O2,此时平衡常数的值约为5×10-80
B.常温下,最易分解放出O2的是水
C.
D.以上都不正确
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省高一3月月考化学试卷(解析版) 题型:选择题
向含有Fe2+、Al3+、NH4+、Na+、K+的溶液中加入过量的Na2O2固体,微热溶液使其充分反应,再通入过量的HCl气体,则反应后溶液中离子浓度大量减小的是
A.Na+和K+ B.Al3+和Na+
C.Fe2+和NH4+ D.Fe2+和K+
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
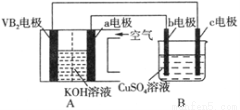
A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
下列有关对定量实验误差分析正确的是
A.现需90ml1.0mol/LNaOH溶液 ,称取3.6gNaOH固体配制——溶液浓度偏低
B.测定溶液 pH的实验中,用润湿的pH试纸测定新制氯水的pH——测定结果偏高
C.中和热实验测定中,缓慢地将NaOH溶液倒入测定装置中——对测定结果无影响
D.酸碱中和滴定实验中,标准液滴定前无气泡而滴定后有气泡——测定结果偏高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:选择题
对于常温下PH=10的氨水,下列说法正确的是
A.该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1
B.该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同
C.降低温度,溶液的c(NH4+)/ c(NH3·H3O)减小,PH降低
D.往该溶液中加入足量的NH4Cl固体后,c(NH4+) + c(NH3·H3O)= c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第二次质量预测理综化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术](15分)利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
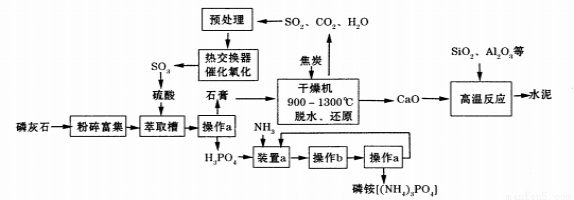
(1)操作a的名称 ,实验室中进行此操作时用到的玻璃仪器有 。
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为 。
(4)水泥常用做建筑材料,是利用了水泥的 性质。
(5)SO2的催化氧化反应为2SO2(g)十02(g)  2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
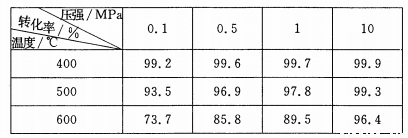
①实际生产中,S02的催化氧化反应是在常压、400 ℃ —500 ℃ 条件下进行。采用常压的主要原因是 ;该反应化学平衡常数大小关系是:K(400 ℃ ) K(500 ℃)(填“>”、“<”或“=” )。
②催化氧化时使用热交换器的原因是 。
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是 。(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2C03溶液、酚酞试液
c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com