
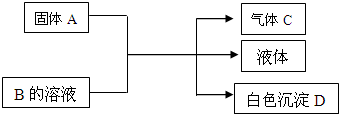
 A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.
A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.分析 (1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,这说明B是铵盐,D是硫酸钡,所以B的化学式为(NH4)2SO4,C为氨气,D为水;
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,所以D应该是氢氧化铝,B是铝盐.
①A是NaHCO3时,Al3+与HCO3-发生双水解反应生成Al(OH)3与CO2.
②A是一种淡黄色固体,则A是过氧化钠,且A与B以物质的量之比为2:1相混合时生成氢氧化铝,这说明B的化学式为Al2(SO4)3,C为氧气;
(3)若A是碳化钙(CaC2),碳化钙溶于水生成氢氧化钙和乙炔,A与B的溶液反应时只生成气体C、CaCO3和水,则B的化学式为Ca(HCO3)2.
解答 解:(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,这说明B是铵盐,D是硫酸钡,所以B的化学式为(NH4)2SO4,C为氨气,D为水,反应的化学方程式为(NH4)2SO4+Ba(OH)2═BaSO4↓+2NH3↑+2H2O,
故答案为:(NH4)2SO4;(NH4)2SO4+Ba(OH)2═BaSO4↓+2NH3↑+2H2O;
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,所以D应该是氢氧化铝,B是铝盐.
①A是NaHCO3时,该反应的离子方程式为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
②A是一种淡黄色固体,则A是过氧化钠,且A与B以物质的量之比为2:1相混合时生成氢氧化铝,这说明B的化学式为Al2(SO4)3,C为氧气,
故答案为:Al2(SO4)3;
(3)若A是碳化钙(CaC2),碳化钙溶于水生成氢氧化钙和乙炔,A与B的溶液反应时只生成气体C、CaCO3和水,则B的化学式为Ca(HCO3)2,
故答案为:Ca(HCO3)2.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物的性质与转化,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) | |
| C. | 分别用蒸馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在CO32- | B. | 溶液中c(H+)•c(OH-)=10-14 | ||
| C. | 与等物质的量的NaOH恰好中和 | D. | 溶液中c(Na+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③④ | C. | ②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等浓度的三种溶液:醋酸钠溶液pH=a,碳酸氢钠溶液pH=b,碳酸钠溶液pH=c,则c>a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH=7 | |
| C. | MgCl2溶液蒸发、结晶得MgCl2•6H2O | |
| D. | 常温下,若1mL pH=1盐酸与100mL NaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
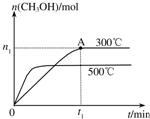 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 其他条件不变,升高温度反应的平衡常数增大 | |
| C. | 300℃时,0-t1min内 CH3OH的平均生成速率为$\frac{{n}_{1}}{2{t}_{1}}$mol•L-1 min-1 | |
| D. | A点的反应体系从300℃升高到500℃,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com