
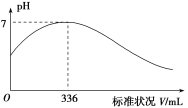
【题目】短周期主族元素X、Y、Z、Q、R的原子序数依次增大,X的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q的单质与稀硫酸剧烈反应生成X的单质。向100mLX2R的水溶液中缓缓通入RZ2气体,溶液pH与RZ2体积关系如下图。下列说法正确的是
A.X2R溶液的浓度为0.03mol·L-1
B.工业上通常采用电解法冶炼Q的单质
C.最简单气态氢化物的稳定性:Y>Z>R
D.RZ2通入BaCl2、Ba(NO3)2溶液中,均无明显现象
【答案】B
【解析】
由条件“X的简单阴离子与锂离子具有相同的结构”可知,X为H元素;由条件“Y原子的最外层电子个数是内层电子数的两倍”可知,Y为C元素;由条件“Q的单质与稀硫酸剧烈反应生成氢气”可知,Q为第三周期的金属元素(Na或Mg或Al);由X可以与R形成H2R化合物可知,R为S元素;S可以与Z形成SZ2气体,所以Z为O元素。
A.硫化氢气体与二氧化硫气体反应的方程式:![]() ;当通入336mL,即0.015molSO2时,溶液恰好为中性,即恰好反应完全,所以原硫化氢溶液中
;当通入336mL,即0.015molSO2时,溶液恰好为中性,即恰好反应完全,所以原硫化氢溶液中![]() ,那么浓度即为0.3mol/L,A错误;
,那么浓度即为0.3mol/L,A错误;
B.Q无论是Na,Mg,Al中的哪一种元素,获得其单质都是采用电冶金的方式,B正确;
C.Y,Z,R分别为C,O,S三种元素,所以简单氢化物的稳定性为H2O>H2S>CH4,即Z>R>Y,C错误;
D.SO2通入BaCl2溶液中无现象,但是通入Ba(NO3)2溶液中会出现白色沉淀,D错误。
答案选B。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:

已知:
①I2(s)+I-(aq)![]() I3-(aq)。
I3-(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO3-离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为___。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是___。
(2)步骤Ⅱ,水合肼与IO反应的离子方程式为___。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。上述①②③操作中,调整pH值时依次加入的试剂为___。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有___。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为___。
(5)将制备的NaI2H2O粗品以无水乙醇为溶剂进行重结晶。请给出合理的操作排序___。
加热乙醇→ → → → →纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③NaI2H2O粗品溶解 ④趁热过滤 ⑤真空干燥 ⑥抽滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A(?)+2B(g) ![]() nC(g)在一定条件下达到平衡后,改变下列条件。请回答
nC(g)在一定条件下达到平衡后,改变下列条件。请回答
(1)增压,平衡不移动,当n=3时,A的状态为______________;
(2)若A为固态,增大压强,C的百分含量增加,则n=________;
(3)升温,平衡向右移动,则该反应的正反应为______________反应(填放热或吸热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是原电池的装置图。请回答:
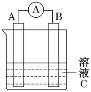
(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___;反应进行一段时间后溶液酸性将__(填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___,B(负极)极材料为__,溶液C为___。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__(填“正极”或“负极”),c电极的反应方程式为__。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型化学实验能有效减少污染,节约药品。下图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体。

(1) 完成本实验中制取Cl2的化学方程式:
__KMnO4+____HCl(浓)—___KCl +_____ MnCl2 + ____ Cl2↑+__ ______ .
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为________ .
⑵b处的实验现象为___________;c处的实验现象为____________
⑶d处反应的离子方程式为_______、_______
⑷通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列有机物:①CH4,②CH3CH2OH,③ ,④癸烷,⑤CH2=CHCH3,⑥
,④癸烷,⑤CH2=CHCH3,⑥![]() ,⑦
,⑦![]() ,⑧丙烷,⑨
,⑧丙烷,⑨![]() ,⑩C5H12O
,⑩C5H12O
根据上述物质,回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为___。
(2)与③互为同分异构体的是__![]() 填序号
填序号![]() 。
。
(3)具有特殊气味,常作萃取剂的某有机物在FeBr3作催化剂的条件下可与液溴发生取代反应,该反应的化学方程式为__。
(4)有机物②在加热条件下和CuO反应的化学方程式为__。
(5)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是__![]() 填序号
填序号![]() 。
。
(6)萘的结构简式是![]() ,其一氯代物有__种。
,其一氯代物有__种。
(7)某摩尔质量为42g/mol的链烃A可使溴水褪色,在一定条件下发生加聚反应的化学方程式___。
(8)分子组成为C5H12O同分异构体中属于醇的有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
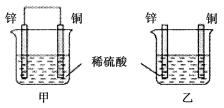
①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO42-向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲乙两烧杯中Cu片的质量均不变
A. ①②③B. ③⑤⑦
C. ④⑤⑥D. ②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是
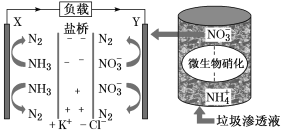
A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com