
分析 平衡时N2物质的量为:2L×1mol/L=2mol,则:
N2 (g)+3H2(g) 2NH3(g)
2NH3(g)
开始(mol):4 10 0
变化(mol):2 6 4
平衡(mol):2 4 4
(1)根据v=$\frac{△c}{△t}$计算v(H2);
(2)氨气体积分数=$\frac{氨气物质的量}{混合气体总物质的量}$;
(3)相同条件下,前后压强之比等于反应前、后气体的总物质的量之比.
解答 解:平衡时N2物质的量为:2L×1mol/L=2mol,则:
N2 (g)+3H2(g) 2NH3(g)
2NH3(g)
开始(mol):4 10 0
变化(mol):2 6 4
平衡(mol):2 4 4
(1)2s内,用H2的浓度变化表示的平均速率v(H2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{6mol}{2L}}{2s}$=1.5 mol/(L•s),
答:2s内的平均速率v(H2)=1.5 mol/(L•s);
(2)平衡时混合气体中氨的体积分数为$\frac{4mol}{2mol+4mol+4mol}$=$\frac{2}{5}$,
答:平衡时氨气的体积发生为$\frac{2}{5}$;
(3)相同条件下,前后压强之比等于反应前、后气体的总物质的量之比,即容器内反应前后压强比为(4mol+10mol):(2mol+4mol+4mol)=7:5,
答:容器内反应前后压强比是7:5.
点评 本题考查化学平衡的有关计算,难度不大,注意基础知识的积累,掌握化学平衡三段式解题法.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 正极反应:O2+2H2O+4e-═4OH- | |
| B. | 当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) | |
| C. | 发生氧化反应的是负极 | |
| D. | 氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 目的 | 操作(文字或图示) | 实验现象 |
| ①催化剂 的影响 | ||
②温度的影响 | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | |
③浓度的影响 | 取两支试管分别加入5mL 5%H2O2溶液和5mL10%H2O2溶液 | 看不到明显的 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
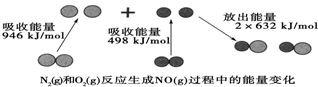 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量大于2mol NO(g)具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
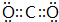 ,BA2分子中化学键属于共价键..
,BA2分子中化学键属于共价键.. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气极易溶于水,所以它是农业上常用的氮肥 | |
| B. | 工业上用H2和N2合成氨与自然界中放电时O2和N2反应都属于氮的固定 | |
| C. | 大型中央空调的致冷剂可用液氨 | |
| D. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com