
| 铁元素的质量 |
| 矿石的质量 |
| ||
| ||
| 铁元素的质量 |
| 矿石的质量 |
| 5cV×56 |
| 1000m |
| 7cV |
| 25m |
| 7cV |
| 25m |


科目:高中化学 来源: 题型:
| A、P(H2)=P(O2)=P(N2) |
| B、P(O2)>P(N2)>P(H2) |
| C、P(H2)>P(N2)>P(O2) |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 锰及其化合物在现代工业及国防建设中具有十分重要的地位.
锰及其化合物在现代工业及国防建设中具有十分重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将一小块钠置于空气中,最终生成NaOH |
| B、实验室可将钠保存于煤油中,也可保存于汽油中 |
| C、金属钠着火后,可用水扑灭 |
| D、金属钠在化学反应中只能作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液:Ca2+、H+、Cl-、HSO3- | ||
B、
| ||
| C、Na2CO3溶液:K+、Na+、SO42--、AlO2- | ||
| D、能使PH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
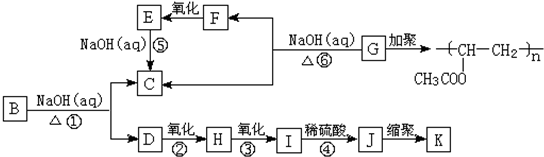
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电离程度:HCN>HClO |
| B、pH:HClO>HCN |
| C、NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
| D、酸根离子浓度:c(ClO-)>c(CN--) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com