
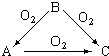
 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.分析 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,B+O2=A,B+O2=C,A+O2=C,推断A为S,B为H2S,C为SO2;依据推断回答问题;
(1)上述分析得到ABC是何物质;
(2)H2S在足量压强中燃烧生成二氧化硫气体;
(3)C为二氧化硫,通入氢氧化钡溶液中生成亚硫酸钡白色沉淀;
解答 解:常温下某淡黄色固体单质A为S,与它的气态氢化物B和氧化物C之间,有如图的转变关系,B+O2=A,B+O2=C,A+O2=C,推断A为S,B为H2S,C为SO2;
(1)上述分析可知A为S,B为H2S,C为SO2;
故答案为:A为S,B为H2S,C为SO2;
(2)B为硫化氢在充足氧气中燃烧,生成C为二氧化硫和水,反应的化学方程式为:2H2S+3O2=2SO2+2H2O;
故答案为:2H2S+3O2=2SO2+2H2O;
(3)将C为二氧化硫通入氢氧化钡溶液中,观察到的现象是出现白色沉淀,反应的化学方程式为:Ba(OH)2+SO2=BaSO3↓+H2O;
故答案为:出现白色沉淀,Ba(OH)2+SO2=BaSO3↓+H2O;
点评 本题考查了硫及其化合物性质的分析判断,掌握反应条件,物质性质和产物判断是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+)=c(OH -)+2c(CO32-)+c(HCO3-) | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡 | |
| D. | 常温常压下能自发进行的反应,一定都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮与水的反应是氧化还原反应 | |
| C. | 二氧化氮不是造成大气污染的气体之一 | |
| D. | 在通常状况下测得的NO2的相对分子质量是不准确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3=57.3 | B. | Q1>Q2>Q3>57.3 | C. | Q3<Q1<Q2=57.3 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 要求 |
| A | Mg2+、SO42-、Cl-、NO3- | c(Mg2+)=c(SO42-) |
| B | Na+、Cu2+、I-、NH3•H2O | 在酸性高锰酸钾溶液中 |
| C | NH4+、Al3+、Cl-、NO3- | 滴加氨水有沉淀产生 |
| D | Cl-、Na+、Cr2O72-、C2H5OH | 溶液无色透明且遇甲基橙显红色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com