

 .
.分析 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y元素最高正价与最低负价之和均为0,氢元素、ⅣA族元素符合,由原子序数可知,X为H元素,Y为C元素;Q与X同主族,Q原子序数大于氧,可知Q为Na,以此解答该题.
解答 解:(1)R为Al,原子核外有3个电子层,最外层电子数为3,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Al>C>O>H,
故答案为:Na>Al>C>O>H;
(3)X为H元素,Y为C元素,能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是C2H2,X和Z组成的化合物的化学式为H2O和H2O2,
故答案为:C2H2; H2O和H2O2;
(4)上述五种元素中的若干种组成的化合物A、B、C、D,其中C是溶于水显酸性的气体,D是淡黄色固体,则C为CO2、D为Na2O2,Na2O2的电子式为 ,
,
故答案为:CO2; ;
;
①如果A、B均由三种元素组成,B为两性不溶物,结合转化关系可知,A为NaAlO2、B为Al(OH)3,偏铝酸根与二氧化碳、水反应生成氢氧化铝与碳酸根,A转化为B的反应离子方程式为:AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2 AlO2-+3 H2O+CO2=2 Al(OH)3+CO32-,
故答案为:AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2 AlO2-+3 H2O+CO2=2 Al(OH)3+CO32-;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,结合转化关系可知,A为Na2CO3、B为NaHCO3,碳酸钠水解的离子方程式为CO32-+H2O?HCO3-+OH-,常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有NaCl、H2CO3、NaHCO3,
故答案为:CO32-+H2O?HCO3-+OH-;NaCl、H2CO3、NaHCO3.
点评 本题考查结构性质位置关系,为高频考点,涉及常用化学用语、无机推断、元素化合物知识等,注意(3)中物质推断是本题的难点、易错点,D淡黄色为突破口,题目难度中等.


科目:高中化学 来源: 题型:解答题

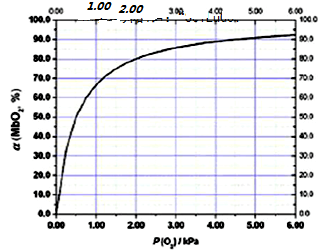
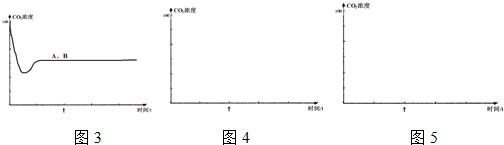
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
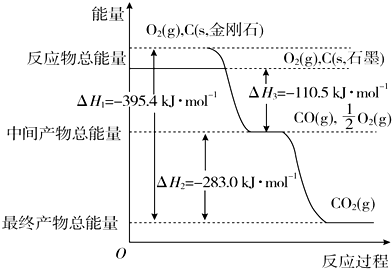
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
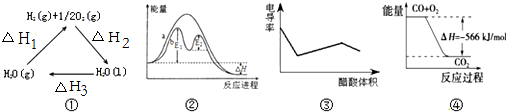
| A. | 图①中△H2=△H1+△H3 | |
| B. | 图②在催化剂条件下,反应的活化能等于E1+E2 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 氯化钴溶液中存在平衡: [Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O;△H=akJ•mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 | |
| D. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.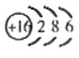 .
.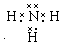 (或
(或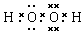 ,
,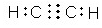 ).
). NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 3mol/LKCl溶液 | B. | 150m L 1mol/LAlCl3溶液 | ||
| C. | 50mL3mol/LMgCl2溶液 | D. | 75mL 1.5mol/LMgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
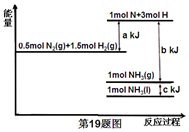
| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com