
已知反应A2(g)+2B2(g)⇌2AB2(g)△H<0,下列说法正确的是( )
|
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 |
|
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
|
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
|
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
考点:
化学平衡的影响因素.
专题:
化学平衡专题.
分析:
A、升高温度正、逆反应速率都增大;
B、升高温度反应速率加快;
C、升温平衡向吸热反应方向进行,增大压强平衡向气体体积减小的方向移动;
D、降低温度平衡向放热反应移动,减小压强平衡向气体体积增大的方向移动.
解答:
解:A、升高温度正、逆反应速率都增大,该反应正反应是放热反应,逆反应速率增大更多,平衡向逆反应移动,故A错误;
B、升高温度反应速率加快,缩短到达平衡的时间,故B正确;
C、该反应正反应是体积减小的放热反应,升高温度有利于平衡向逆反应移动,增大压强有利于平衡向气正反应移动,故C错误;
D、该反应正反应是体积减小的放热反应,降低温度,平衡正向进行,减小压强平衡向气体体积增大的方向移动,即向逆反应移动,故D错误;
故选B.
点评:
本题考查外界条件对化学平衡的影响,难度中等,注意基础知识的理解掌握和化学平衡移动原理的理解应用.


科目:高中化学 来源: 题型:
乙醇与钠反应的现象描述正确的是( )
|
| A. | 浮在乙醇面上,融化成闪亮的小球 |
|
| B. | 沉到乙醇底部,融化成闪亮的小球 |
|
| C. | 沉到乙醇底部,缓慢产生气泡,钠不融化 |
|
| D. | 浮在乙醇面上,钠不融化但四处游动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列不属于取代反应的是( )
|
| A. | CH4+Cl2 |
|
| B. | CH3Cl+Cl2 |
|
| C. | CH3OH+HCl |
|
| D. | CH2=CH2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2升的密闭容器中,发生以下反应:2A(g)+B(g)⇌2C(g)+D(g).若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12mol/(L•s),则10秒钟时,容器中B的物质的量是( )
|
| A. | 1.6 mol | B. | 2.8 mol | C. | 2.4 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是( )
|
| A. | 滴定前滴定管中有气泡,滴定后消失 |
|
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 |
|
| C. | 滴定时达到滴定终点时俯视读数 |
|
| D. | 锥形瓶取用NaOH待测液前加少量水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请回答下列问题:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .直到因加入一滴盐酸后,溶液由黄色变为橙色,并 为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是 (填字母)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面分别如图所示,则起始读数为 mL,终点读数为 26.10 mL;所用盐酸的体积为 mL.
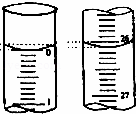
查看答案和解析>>
科目:高中化学 来源: 题型:
A—I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为 B、C、D第一电离能由小到大的顺序为 (填写元素符号)
 (2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
(2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
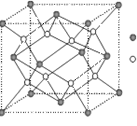
(3)D与G可以形成右图的晶胞,则黑点表示的是 元素(填写元素符号),该元素原子在该晶胞中的配位数为
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为 ,若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,该晶胞中成键原子键角为 。
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为 如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为 。(阿伏加德罗常数用NA表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式,错误的是()
A. 铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
B. 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O
C. 铁投入硫酸铜溶液中:Fe+Cu2+═Cu+Fe2+
D. KHCO3溶液中滴加H2SO4溶液:HCO3﹣+H+=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com