
| A. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| B. | Y元素最高价氧化物对应的水化物化学式为H2YO4 | |
| C. | 原子半径由大到小的顺序为Z>Y>W | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
分析 X、Y、Z、W为四种短周期主族元素,W是短周期主族元素中原子半径最大的,则W为Na元素;X原子最外层电子数是核外电子层数的3倍,只能有电子层数为2,最外层电子数为6,则X为O元素;X、Z同族,则Z为S元素;Y的最高正价与最低负价代数和为6,其最高价为+7价,Y、Z同周期,Y为Cl元素,然后利用元素及其单质、化合物的性质来解答.
解答 解:X、Y、Z、W为四种短周期主族元素,W是短周期主族元素中原子半径最大的,则W为Na元素;X原子最外层电子数是核外电子层数的3倍,只能有电子层数为2,最外层电子数为6,则X为O元素;X、Z同族,则Z为S元素;Y的最高正价与最低负价代数和为6,其最高价为+7价,Y、Z同周期,Y为Cl元素,
A.非金属性Cl>S,则Cl、S两种元素气态氢化物中,Cl的气态氢化物较稳定,故A错误;
B.Cl元素最高价氧化物对应水化物化学式为HClO4,故B错误;
C.元素周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Na>S>Cl,即Z>W>Y,故C错误;
D.X与W形成的两种化合物为Na2O、Na2O2,阴、阳离子物质的量之比均为1:2,故D正确;
故选D.
点评 本题考查位置结构性质的相互关系应用,题目难度不大,注意把握化合价与原子结构与族序数关系,注意熟练掌握元素周期律、熟悉元素及其化合物的性质,试题培养了学生的分析能力及灵活应用能力.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
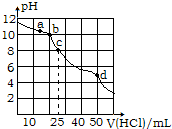
| A. | 该温度下HCO3-的水解常数约为2×10-11 | |
| B. | a点到b点发生的主要离子反应为:HCO3-+H+═H2O+CO2↑ | |
| C. | c点:c(OH-)+c(CO32-)=c(H+)+2c(H2CO3) | |
| D. | d点:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 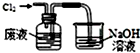 氧化废液中的溴化氢 | B. | 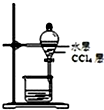 分离CCl4层和水层 | ||
| C. |  分离CCl4和液溴 | D. |  长期贮存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个Al(OH)3胶体粒子的质量为78g | |
| B. | 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 在0.1mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.1NA | |
| D. | 标准状况下,2.24 L己烷中共价键数目为1.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 | 900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| A. | 实验①中,若5min时测得n(M)=0.050mol,则0~5min时间内,用N表示的平均反应速率v(N)=l.0×10-2 mo1•L-1•min-1 | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 该反应的正反应方向为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W |
| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y的最高价氧化物能溶于烧碱溶液 | |
| C. | X与W形成的化合物中含有离子键 | |
| D. | Z、W分别形成的简单离子中,前者的半径较大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com