
【题目】从 KNO3和少量 NaCl 杂质的混合物中提纯 KNO3.涉及的操作依次有:①溶解 ②过滤 ③结晶 ④冷却 ⑤蒸发浓缩.其中合理的是( )
A. ①②③④⑤ B. ①⑤④③② C. ①③⑤④② D. ①②⑤③④
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的Fe2+、SO42-和较多的Cu2+及少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和 括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实 验方案。
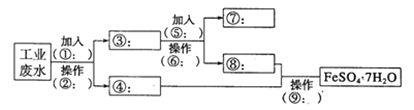
(1)操作②的名称为__________,所需要的玻璃仪器为__________、玻璃棒、烧杯。
(2)试剂⑤的化学式为__________,发生化学反应的离子方程式为__________。
(3)为验证溶液⑧中含有SO42-:取少量的溶液⑧于试管中,先加入____再加入__________,若观察到有白色沉淀,则说明溶液⑧中含有SO42-。写出上述反应的离子方程式______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.CS2为V形的极性分子
B.ClO3﹣的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO3的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
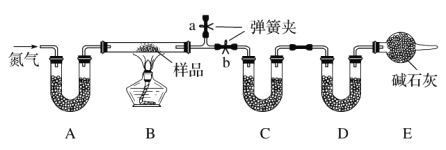
(1)加热前通入氮气的目的是__________,操作方法为_______________。
(2)装置A、C、D中盛放的试剂分别为A_____,C_____,D_____。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将_____(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将_____;若撤去E装置,则测得Na2CO3·10H2O的含量将_____。
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为_______(用含w、m1、m2的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:

(1)保存过氧化氢的试剂瓶上最适合贴的标签是_____________(填字母)。
(2)下列反应中,H2O2体现还原性的是______________。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
D.K2Cr2O7+4H2O2+2H+ =2CrO5+5H2O[CrO5称为过氧化铬,可写成CrO(O2)2]
(3)采矿废液中的氰化物(如KCN)一般用H2O2做无毒化处理,化学方程式为:KCN+H2O2+H2O=KHCO3+NH3↑(KCN中N为﹣3价),生成1mol NH3时转移的电子数为___________。
(4)H2O2被称为绿色氧化剂的理由是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4电解液继而提取锰的工业流程如下
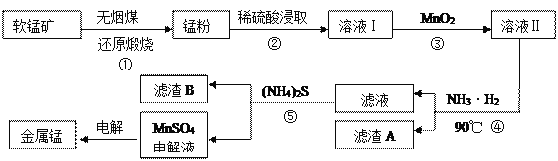
(1)已知锰粉的主要成分为MnO,反应①的化学方程式为________________________。
(2)实验室可用软锰矿与浓盐酸反应制Cl2,比较MnO2、C12、Fe3+的氧化性强弱:_______。
(3)溶液I中加入一定质量的MnO2以测定Fe2+的浓度,加入MnO2有关反应的离子方程式为___________________________________________________________________。
(4)已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-25,要使滤渣A沉淀完全,需用氨水调pH至少为______(已知lg 3≈0.5)。
(5)溶液Ⅰ的主要成分为 ____________。滤渣B的主要成分为_________________。
(6)工业上用二氧化锰制备高锰酸钾,先用二氧化锰制得锰酸钾,再用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
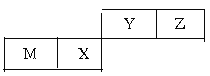
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. 原子半径Z<M
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第2周期、第ⅥA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com