
分析 发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,n(NaHCO3)=$\frac{16.8g}{84g/mol}$=0.2mol,结合反应计算.
解答 解:(1)加热NaHCO3时发生的化学反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)n(NaHCO3)=$\frac{16.8g}{84g/mol}$=0.2mol,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
2 1
0.2mol n(Na2CO3)
n(Na2CO3)=0.1mol,
m(Na2CO3)=0.1mol×106g/mol=10.6g,
即剩余物质是Na2CO3,质量为10.6g,物质的量为0.1mol,
故答案为:Na2CO3;10.6g;0.1mol.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意物质的量的相关计算,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯的同系物都能使酸性高锰酸钾溶液褪色 | |
| B. | 红外光谱、核磁共振氢谱都可以鉴别乙醇和甲醚 | |
| C. | 符合相同通式的不同物质一定是同系物 | |
| D. | 某有机物燃烧后只生成二氧化碳和水,则一定不含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 7.8gNa2O2中含有阴离子数目为0.2NA | |
| C. | 71g氯气溶于水配成溶液,所得溶液中含Cl-数目为1 NA | |
| D. | 4℃,18g水所含分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400 mL | B. | 600 mL | C. | 500 mL | D. | 480 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 气体发生装置 | 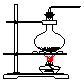 a | 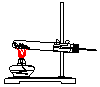 b |  c |
| 气体收集装置 |  2 |  ② |  ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5a×10-4mol | B. | a×10-3mol | C. | 7.5a×10-4mol | D. | a×10-4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧,发出黄色火焰 | |
| B. | 钠在空气中燃烧,产物是Na2O | |
| C. | 钠是银白色金属,硬度大,熔点高 | |
| D. | 取用金属钠时,剩余的钠不能放回原瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com