
下列除去杂质所用的试剂与方法均正确的是
A.苯中含有苯酚杂质:加入溴水,过滤
B.乙醇中含有乙酸杂质:加入饱和碳酸钠溶液,分液
C.溴苯中含有溴杂质:加入NaOH溶液,分液
D.CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:实验题
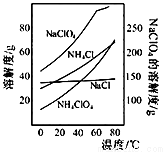
高氯酸铵可用于火箭推进剂,实验室可由NaClO等原料制取(部分物质溶解度如下图),其实验流程如下:
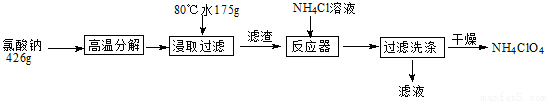
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为_____________________。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为_________________(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为_____________________
(4)已知:2NH4C1O4 N2+2O2↑+C12↑+4H2O,现可提供下列试剂:
N2+2O2↑+C12↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.CuO e.Cu
利用下图装置对高氯酸 铵热分解产生的三种气体进行分别吸收或收集。
铵热分解产生的三种气体进行分别吸收或收集。

①E中收集到的气体可能是__________(填化学式)。
②A、B、C中盛放的药品依次可以是_________(选填:I、II、III)。
I.a、b、d II.c、b、d III.c、b、e
(5)过滤用到的主要玻璃仪器是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:实验题
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为 合成氨的原料。完成下列填空:
合成氨的原料。完成下列填空:
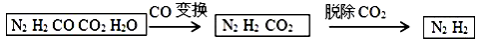
(1)半水煤气含有少量硫化氢。将半水煤气样品通入 溶液中(填写试剂名称),出现 ,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式 ;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中: V(H2): V(N2)=__________。
V(H2): V(N2)=__________。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠洛液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c mol.L-1的标准盐酸溶液VlmL,此时再向溶液中滴入1-2滴__________做指示剂,达到滴定终点时又用去V2mL标准盐酸溶液。
第二次滴定达到终点时的现象是______________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则____________(填化学式)浓度偏大。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
其他条件不变,升高温度下列数据不一定增大的是( )
A.可逆反应的化学平衡常数K B.0.1 mol/L CH3COONa溶液的pH
C.水的离子积常数KW D.弱电解质的电离程度
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:填空题
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备C lO2,反应如下:
lO2,反应如下:
NaCl O2+HCl→ClO2↑+NaCl+H2O(没有配平)
O2+HCl→ClO2↑+NaCl+H2O(没有配平)
(1)配平方程式。
 NaClO2+
NaClO2+ HCl—
HCl— ClO2↑+
ClO2↑+ NaCl+
NaCl+ H2O
H2O
(2)该反应中氧化剂和还原剂的物质的量之比_______________________。生成0.2 mol ClO2转移电子的物质的量为________mol。
(3)ClO2对污水中的Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN- a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2________mol。
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:选择题
在传统的硝化法制硫酸 中,其关键反应为NO2 + SO2 = NO + SO3,2NO + O2 = 2NO2 ,SO3 + H2O = H2SO4。据此,对有关物质氧化性的相对强弱顺序判断正确的是( )
中,其关键反应为NO2 + SO2 = NO + SO3,2NO + O2 = 2NO2 ,SO3 + H2O = H2SO4。据此,对有关物质氧化性的相对强弱顺序判断正确的是( )
A.H2SO4>NO2>O2 B.O2>SO3>H2SO4
C.NO2>O2>SO3 D.O2>NO2>SO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:实验题
某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体___________g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
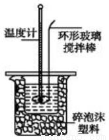
取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
(1)写出该反应的热化学方程式为___________(中和热为57.3kJ/mol);
(2)①请填写下表中的空白:
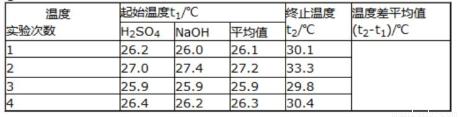
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃)。则中和热△H=___________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___________(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
室温下将a mL三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) / mol·L-1 | 混合溶液的pH |
甲 | c(HX)=0.1 mol·L-1 | 0.1 | pH = 10 |
乙 | c(HY)=0.1 mol·L-1 | 0.1 | pH = 7 |
丙 | c(HZ)=0.1 mol·L-1 | 0.1 | pH = 9 |
(1)根据表中数据比较HX、HY、HZ三种酸的酸性由强到弱的顺序为_________,丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-)= mol·L-1。
(2)部分实验反应过程中的pH变化曲线如下图:
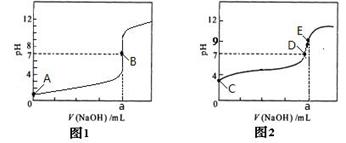
①表示乙组实验的pH变化曲线是________________(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是________________。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性。
①浓度为1.0×10-3 mol·L-1的氨水b L
②c(OH-)=1.0×10-3 mol·L-1的氨水c L
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。则a、b、c、d的大小关系是_________________。
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是__________(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1__________m2(填“<”、“=”、“>”)
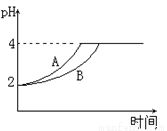
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:选择题
在25℃时,将amol/L的氨水与0.01mol/L的HCl溶液等体积混合,反应后溶液呈中性,下列说法不正确的是(忽略溶液混合后体积的变化)
A.溶液中c(NH4+)=c(Cl-)
B.此时水的电离程度最大
C.此时溶液中NH3·H2O的物质的量浓度为1/2[(a-0.01)]mol/L
D.用含a 的代数式 NH3·H2O的电离平衡常数Kb=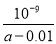 (mol/L)
(mol/L)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com