
分析 一定温度下,将3molA气体和1molB气体通入一密闭容器中,若容器体积固定为 2L,反应1min时测得剩余1.8mol A,C的浓度为0.4mol/L,则:
3A(g)+B(g)?x C(g)
起始量(mol):3 1 0
变化量(mol):1.2 0.4 0.4x
1min时(mol):1.8 0.6 0.4x
故$\frac{0.4xmol}{2L}$=0.4mol/L,解得x=2,
(1)根据v=$\frac{△c}{△t}$计算v(B);
(2)后1min内速率小于前1min内反应速率,故后1min内C的浓度变化量小于0.4mol/L;
(3)随反应进行混合气体物质的量减小,恒温恒容下平衡时压强减小,若维持容器压强不变,等效为在原平衡基础上增大压强,平衡正向移动.
解答 解:一定温度下,将3molA气体和1molB气体通入一密闭容器中,若容器体积固定为 2L,反应1min时测得剩余1.8mol A,C的浓度为0.4mol/L,则:
3A(g)+B(g)?x C(g)
起始量(mol):3 1 0
变化量(mol):1.2 0.4 0.4x
1min时(mol):1.8 0.6 0.4x
故$\frac{0.4xmol}{2L}$=0.4mol/L,解得x=2,
(1)v(B)=$\frac{\frac{0.4mol}{2L}}{1min}$=0.2mol/(L.min)
故答案为:0.2mol/(L.min);
(2)后1min内速率小于前1min内反应速率,故后1min内C的浓度变化量小于0.4mol/L,故2min达到平衡,平衡时C的浓度小于0.8mol/L,故答案为:小于;
(3)随反应进行混合气体物质的量减小,恒温恒容下平衡时压强减小,若维持容器压强不变,等效为在原平衡基础上增大压强,平衡正向移动,达到平衡时C的体积分数大于22%,
故答案为:大于.
点评 本题考查化学平衡计算与影响因素、反应速率计算与影响因素,(2)中注意根据反应速率分析前、后1min内C的浓度变化量,(3)中注意利用等效平衡分析解答,难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液加入盐酸,有无色无味气体产生 | 溶液一定含有CO32- |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液一定含Fe2+ |
| C | 向某溶液滴加浓NaOH溶液加热,有能使湿润的红色石蕊试纸变蓝的气体产生 | 溶液一定存在NH4+ |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管中有晶体凝结 | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
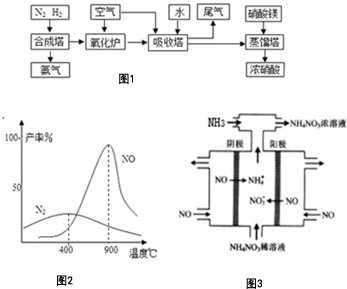 氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题
氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,也可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
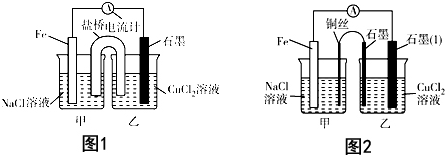

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
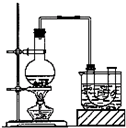 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com