
 .
. .
.分析 A、B、C、D四种短周期元素,它们原子的核电荷数依次递增:
A原子核内仅有1个质子,应为H元素;
D原子最外层电子数是其电子层数的3倍,则有两个电子层,最外层电子数为6,则D为O元素;
B原子的电子总数与D原子的最外层电子数相等,则B为C元素;
C的原子序数介于C、O之间,所以C是N元素;结合元素化合物的性质解答.
解答 解:A、B、C、D四种短周期元素,它们原子的核电荷数依次递增:
A原子核内仅有1个质子,应为H元素;
D原子最外层电子数是其电子层数的3倍,则有两个电子层,最外层电子数为6,则D为O元素;
B原子的电子总数与D原子的最外层电子数相等,则B为C元素;
C的原子序数介于C、O之间,所以C是N元素;
①A与D组成的化合物中,含有非极性键的分子为H2O2,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,
,
故答案为: ;.
;.
②B与D组成的三原子分子为CO2,其结构式为O=C=O;
故答案为:O=C=O;
③A与C组成的化合物分子NH3,其电子式为 ;
;
故答案为: ;
;
④已知A、B、C、D可组成一种化合物,其原子个数比为8:1:2:3,该化合物的化学式为(NH4)2CO3,(NH4)2CO3中铵根离子与碳酸根离子之间以离子键结合,所以属于离子化合物;
故答案为:(NH4)2CO3;离子.
点评 本题考查了元素的推断、常用化学用语,明确原子的电子层结构是解本题的关键,难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,压强为反应前的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
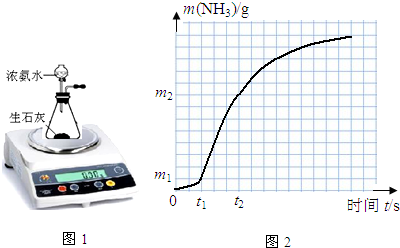
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
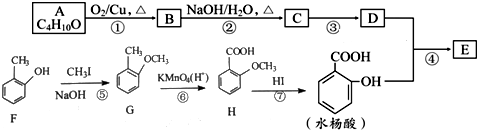
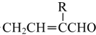
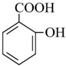 →
→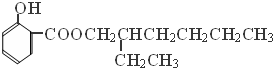 +H2O;
+H2O;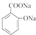
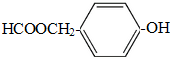 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
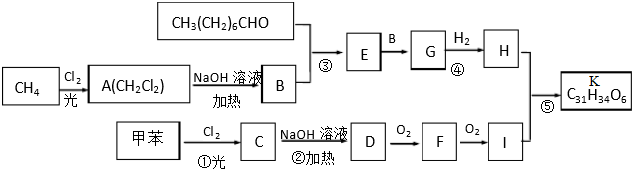
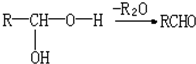
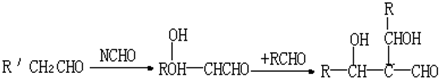
 .
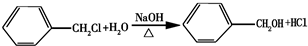
.
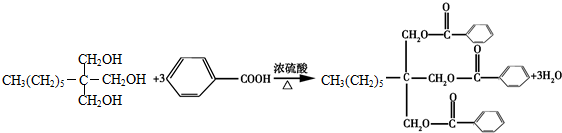
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.08 g | B. | 1.28 g | C. | 2.16 g | D. | 4.32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 金属性的强弱:f<g | |
| C. | 元素e的氧化物只能与酸反应 | |
| D. | 最高价氧化物对应的水化物的碱性:e<g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2 Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com