
在中性或碱性溶液中Na2SO3与S可以顺利反应合成大苏打(Na2S2O3·5H2O);反应的化学方程式如下:Na2SO3+S+5H2O=Na2S2O3·5H2O
现用Na2S和Na2CO3的混合液.Na2SO3固体.稀硫酸等试剂合成大苏打,按下列要求回答问题:
(1)制取SO2的化学方程式为________.
(2)反应过程中溶液的pH值逐渐下降,同时有S生成的化学方程式是:
①________________.
②________________.
③________________.
(3)合成大苏打时,Na2S与Na2CO3的最适宜的物质的量之比为________.
(4)当溶液的pH值下降到7左右,在加热条件下,溶液变为无色澄清时,欲得Na2S2O3·5H2O晶体,可采取的措施是________.
①趁热过滤 ②蒸发浓缩后冷却结晶
(5)在图所示的方框中画出发生气体的实验装置示意图(包括反应时容器中的物质),已知气流方向从左到右.


②铁架台、石棉网、酒精灯、玻璃导管之间的连接等,在示意图中不必画出.如需加热可在需要加热的仪器下方标出“Δ”.
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:阅读理解
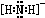
查看答案和解析>>
科目:高中化学 来源: 题型:
 KMnO4的氧化性随pH的减小而增大.其在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2.
KMnO4的氧化性随pH的减小而增大.其在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2.查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高二上学期末考试化学试卷(解析版) 题型:实验题
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
①滴定管如图所示,用 滴定管盛装标准浓度的氢氧化钠溶液(填“甲”或“乙”)。

②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
|
实验编号 |
待测HCl溶液的体积(mL) |
滴入NaOH溶液的体积(mL) |
|
1 |
20.00 |
23.00 |
|
2 |
20.00 |
23.10 |
|
3 |
20.00 |
22.90 |
该未知盐酸的浓度为(保留两位有效数字)_______________。
③下列操作会使所测得的盐酸的浓度偏低的是__________:
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(2)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
请回答下列问题:
①判断滴定达到终点的现象是_______________________________________________。
②考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈_____(选填“酸性”、“中性”或“碱性”)为宜。
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果________(选填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 KMnO4的氧化性随pH的减小而增大.其在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2.
KMnO4的氧化性随pH的减小而增大.其在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2.查看答案和解析>>
科目:高中化学 来源: 题型:
I、 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1) ①HClO4、②HIO4、③H5IO6 的酸性由强到弱的顺序为 (填序号)。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 。
(5)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 。
II.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴ 出N2H62+在足量碱性溶液中反应的离子方程式 。
⑵NH2-的电子式为 。
(3)写出两种由多个原子组成的含有与N3-电子数相同的物质的化学式 。
(4)等电子数的微粒往往具有相似的结构,试预测N3—的构型 。
(5)据报道,美国科学家1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片 所带电荷是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com