
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
科目:高中化学 来源: 题型:解答题
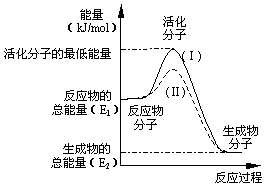 请认真观察图并利用所学的活化能的知识,回答下列问题:
请认真观察图并利用所学的活化能的知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和醇发生的反应一定是酯化反应 | |
| B. | 由乙烯生成乙醇属于还原反应 | |
| C. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氯化亚铁溶液:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠加入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
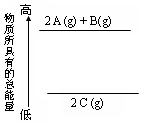
| A. | 2A+B=2C;△H<0 | B. | 2C(g)=2 A(g)+B(g);△H<0 | ||
| C. | 2A(g)+B(g)=2 C(g);△H>0 | D. | 2A(g)+B(g)=2 C(g);△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
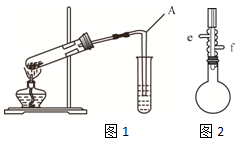 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题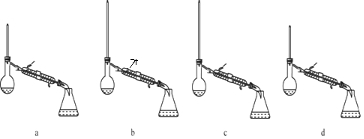
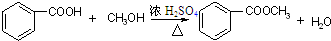 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ④⑤ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阴离子 | SO42-、NO3-、CO32-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
| A. | 若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象为有血红色沉淀生成 | |
| B. | 原溶液中含有的阳离子为Fe2+、Al3+ | |
| C. | 用排水法可收集所产生的气体体积为$\frac{22.4}{3}$L | |
| D. | a=160 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com