
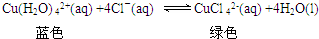
分析 (1)在加热条件下浓盐酸与二氧化锰反应生成氯气、氯化锰和水;
(2)调节pH时不能消耗铜离子,也不能引入新的杂质;
(3)①铜离子水解显酸性,加酸抑制水解;
②根据反应方程式书写,水不能写入平衡常数表达式;溶液由绿色变成蓝色,则平衡逆向移动,根据影响化学平衡移动的因素分析;
(4)CuSO4在溶液中水解生成难挥发性酸,水解不能完全进行.
解答 解:(1)在加热条件下浓盐酸与二氧化锰反应生成氯气、氯化锰和水,其反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)调节pH时不能消耗铜离子,也不能引入新的杂质,加NaOH会引入钠离子,Cu与氢离子不反应,所以可以选用CuO和Cu2(OH)2CO3 ;
故答案为:ac;
(3)①铜离子水解显酸性,加酸抑制水解,所以蒸发过程中,要加入盐酸来抑制氯化铜的水解,从而提高产率;
故答案为:抑制铜离子的水解,提高产品的产率;
②蒸发过程中,观察到溶液颜色由蓝色变为绿色,其原理是: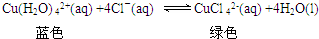 ,则反应的平衡常数为K=$\frac{c[CuC{{l}_{4}}^{2-}]}{c[Cu({H}_{2}O{)_{4}}^{2-}]•{c}^{4}(C{l}^{-})}$;溶液由绿色变成蓝色,则平衡逆向移动,加水稀释,平衡逆向移动,加AgNO3溶液会消耗氯离子,反应物的浓度减小,平衡逆向移动;
,则反应的平衡常数为K=$\frac{c[CuC{{l}_{4}}^{2-}]}{c[Cu({H}_{2}O{)_{4}}^{2-}]•{c}^{4}(C{l}^{-})}$;溶液由绿色变成蓝色,则平衡逆向移动,加水稀释,平衡逆向移动,加AgNO3溶液会消耗氯离子,反应物的浓度减小,平衡逆向移动;
故答案为:K=$\frac{c[CuC{{l}_{4}}^{2-}]}{c[Cu({H}_{2}O{)_{4}}^{2-}]•{c}^{4}(C{l}^{-})}$;加水稀释;AgNO3溶液;
(4)CuSO4在溶液中水解生成难挥发性酸硫酸,加热促进水解,但水解生成的硫酸不挥发,随着水的减少,硫酸的浓度越来越大,从而抑制了硫酸铜的水解,最终得到晶体;
故答案为:加热促进水解;但硫酸不挥发,且浓度越来越大,从而抑制水解;水不断蒸发,最终得到晶体.
点评 本题以铜的化合物的有关知识为背景,考查了元素化合物的性质、气体的制备原理、除杂质、盐的水解原理、化学平衡移动等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用酒精清洗做过碘升华的烧杯 | |
| B. | 用水清洗做过银镜反应的试管 | |
| C. | 用浓盐酸清洗做过高锰酸钾分解实验的试管 | |
| D. | 用氢氧化钠溶液清洗盛过苯酚的试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入一小块铜片 | B. | 改用等体积 98%的硫酸 | ||
| C. | 用等量铁粉代替铁片 | D. | 改用等体积3mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
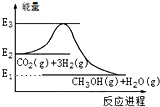
| A. | E2_E1是该反应的热效应 | |
| B. | E3_E1是该反应的热效应 | |
| C. | 该反应放热,在常温常压下就能进行 | |
| D. | 实现变废为宝,且有效控制温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶质的电离方程式为NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(HSO3-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量与白色固体的质量均保持不变 | |
| B. | 溶液浓度和pH值均保持不变,溶液下部是1.73g氢氧化钡固体 | |
| C. | 溶液中钡离子与氢氧根离子的数目均保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 | |
| D. | 溶液中钡离子与氢氧根离子的物质的量的浓度保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com