
1)在一个容积为3L的密闭容器内进行如下反应:N2(气)+3H2(气)⇌2NH3(气).反应开始时,n(N2)=1.5mol,n(H2)=4.4mol,2min后达到平衡状态,n(H2)=3.5mol.用NH3的浓度变化来表示该反应的反应速率为 ,2min末N2的浓度 ,平衡时N2的转化率为 .
(2)在密闭容器中,对于反应:N2(g)+3H2(g)⇌2NH3(g),在反应起始时N2和H2 分别为5mol和15mol,当达到平衡时,N2的转化率为20%.若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物质的量为 ,NH3的转化率 .
考点: 化学平衡的计算.
专题: 化学平衡专题.
分析: (1)根据反应速率v(NH3)= ,N2的浓度c(N2)=
,N2的浓度c(N2)=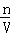 ,N2的转化率=
,N2的转化率= ,利用好方程式利用三段式进行解答,得出正确结论;
,利用好方程式利用三段式进行解答,得出正确结论;
(2)从氨气开始进行化学反应,平衡时各组分的含量相同,二者为等效平衡:
恒温恒容,按化学计量数转化到左边满足n(N2)=5mol、n(H2)=15mol即可,根据原平衡时氮气转化率计算原平衡体系中氮气的物质的量,据此计算参加反应的氨气的物质的量,再根据转化率定义计算.
解答: 解:(1)N2(气)+3H2(气)⇌2NH3(气)
起始 1.5 4.4 0
转化 0.3 0.9 0.6
平衡 1.2 3.5 0.6
v(NH3)= =
=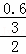 =0.1mol•L﹣1•min﹣1,c(N2)=
=0.1mol•L﹣1•min﹣1,c(N2)=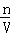 =
=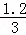 =0.4 mol.L﹣1,氮气的转化率=
=0.4 mol.L﹣1,氮气的转化率=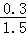 ×100%=20%
×100%=20%
故答案为:0.1 mol•L﹣1•min﹣1;0.4 mol•L﹣1;20%;
(2)从氨气开始进行化学反应,平衡时各组分的含量相同,二者为等效平衡:
恒温恒容,按化学计量数转化到左边满足n(N2)=5mol、n(H2)=15mol,氮气与氢气的物质的量之比等于化学计量数之比,由方程式可知n(NH3)=2n(N2)=2×5mol=10mol,
原平衡时氮气转化率为20%,则原平衡体系中氮气的物质的量为5mol×(1﹣20%)=4mol,故从氨气建立平衡生成的氮气为4mol,由方程式可知,参加反应的氨气的物质的量为4mol×2=8mol,故从氨气建立等效平衡,氨气的转化率为: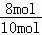 ×100%=80%;
×100%=80%;
故答案为:10 mol;80%.
点评: 本题考查化学平衡及其等效平衡的有关计算,难度中等,注意把握三段式和理解等效平衡规律是解题关键:1、恒温恒容,反应前后气体体积不等,按化学计量数转化一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化一边,对应物质满足等比,2:恒温恒压,按化学计量数转化一边,对应物质满足等比.


科目:高中化学 来源: 题型:
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)()
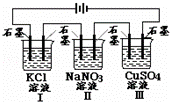
A. 13、7、1 B. 12、7、2 C. 1、7、13 D. 7、13、1
查看答案和解析>>
科目:高中化学 来源: 题型:
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动,下列叙述正确的是()
①生成物的质量分数一定增加;②生成物的物质的量一定增加;
③反应物的转化率一定增大;④平衡时反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率;⑥一定使用了催化剂.
A. ①②⑤ B. ④⑥ C. ②⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2和1mol H2,在Ⅲ中充入2mol CO和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是()
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中CO的物质的量比容器Ⅱ中的多
D. 容器Ⅰ中CO的物质的量比容器Ⅱ中的少
查看答案和解析>>
科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)⇌N2(g)+2CO2(g),下列说法不正确的是()
A. 升高温度可使该反应的逆反应速率降低
B. 使用高效催化剂可有效提高正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是()
A. V1>V2>V3 B. V1<V2<V3 C. V1=V2>V3 D. V1=V2<V3
查看答案和解析>>
科目:高中化学 来源: 题型:
由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti已知:①C(s)+O2(g)=CO2(g);△H=﹣393.5kJ•mol﹣1②2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ•mol﹣1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol﹣1,则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ/mol.
Ti已知:①C(s)+O2(g)=CO2(g);△H=﹣393.5kJ•mol﹣1②2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ•mol﹣1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol﹣1,则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ/mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com