
 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®øĆČÜŅŗÖŠŅ»¶Ø²»ŗ¬¼ŲŌŖĖŲ | B£®øĆČÜŅŗÖŠ²»æÉÄÜŗ¬ÄʵĻÆŗĻĪļ |
| C£®øĆČÜŅŗÖŠ²»æÉÄÜŗ¬Äʵ„ÖŹ | D£®øĆČÜŅŗÖŠæÉÄÜŗ¬ÄʵĻÆŗĻĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 .24Éż(±ź×¼×“Ģ¬)°±ĘųĶØČė250mLÅضČĪŖ0.1mol”¤L£1µÄĮņĖįČÜŅŗÖŠ£¬³ä·Ö·“Ó¦ŗóČÜŅŗÖŠø÷Ąė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ”””””£
.24Éż(±ź×¼×“Ģ¬)°±ĘųĶØČė250mLÅضČĪŖ0.1mol”¤L£1µÄĮņĖįČÜŅŗÖŠ£¬³ä·Ö·“Ó¦ŗóČÜŅŗÖŠø÷Ąė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ”””””£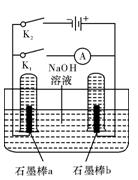
 Ā·ÖŠÓŠµēĮ÷Ķعż”£Š“³öa¼«µÄµē¼«·“Ó¦Ź½ ”””£
Ā·ÖŠÓŠµēĮ÷Ķعż”£Š“³öa¼«µÄµē¼«·“Ó¦Ź½ ”””£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
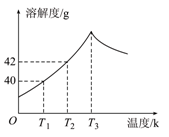
| A£®Š”ÓŚ40g | B£®µČÓŚ40g | C£®µČÓŚ42g | D£®“óÓŚ42g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®³£ĪĀĻĀŌŚĖį¶ČAG=lg”²c(H+)/c(OH-)”³=10µÄČÜŅŗÖŠ£ŗFe2+”¢K+”¢NO3-”¢SO42- |
| B£®ÄÜČܽāNH4HCO3¹ĢĢå²śÉśĘųÅŻµÄČÜŅŗÖŠ£ŗAlO2-”¢HCO3-”¢Ba2+”¢NO3- |
| C£®Ź¹¼×»ł³Č±äŗģµÄČÜŅŗÖŠ£ŗNH4+ ”¢Na+”¢SO42£”¢Cl- |
| D£®ÄÜŹ¹µķ·Ūµā»Æ¼ŲŹŌÖ½ĻŌĄ¶É«µÄČÜŅŗ£ŗK+”¢NH4+ ”¢SO42£”¢S2£ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®K£«”¢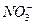 ”¢ ”¢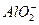 ”¢OH£ ”¢OH£ | B£®Fe3£«”¢Ba2£«”¢H£«”¢I£ |
C£®H£«”¢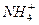 ”¢Cl£”¢ ”¢Cl£”¢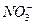 | D£®Na£«”¢Al3£«”¢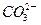 ”¢ ”¢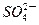 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Na+”¢Cu2+”¢NO3-”¢CO32- | B£®Al 3+”¢K+”¢Cl-”¢HCO3- |
| C£®Fe2+”¢ Na+”¢SO42-”¢NO3- | D£®Mg2+”¢NH4+”¢SO42-”¢Cl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| (1) | 0.15mol | 0.1mol | 0.05mol | ”Ŗ |
| (2) | 0.05mol | 0.15mol | ”Ŗ | 0.05mol |
| A£®½öc£ØK+£©ĻąĶ¬”””””” | B£®ĶźČ«ĻąĶ¬”””””” |
| C£®½öc£ØCl-£©ĻąĶ¬”””” | D£®ĶźČ«²»Ķ¬ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com