
| A£ģ2H2(g)+O2(g)=2H2O(l)¶§H= £≠Q1kJ°§mol-1£Ľ 2H2(g)+O2(g)=2H2O(g)¶§H=£≠Q2kJ°§mol-1 |
| B£ģS(g)+O2(g)=SO2(g)¶§H = £≠Q1 kJ°§mol-1£Ľ S(s)+O2(g)=SO2(g)¶§H=£≠Q2kJ°§mol-1 |
| C£ģC(s)+1/2O2(g)=CO(g)¶§H = £≠Q1 kJ°§mol-1£Ľ C(s)+O2(g)=CO2(g)¶§H=£≠Q2kJ°§mol-1 |
| D£ģH2(g)+Cl2(g)=2HCl(g)¶§H = £≠Q1kJ°§mol-1£Ľ 1/2H2(g)+1/2Cl2(g)="HCl(g)" ¶§H= £≠Q2kJ°§mol-1 |
 ņŤ√ųőńĽĮļģľŔ◊ų“ĶŌĶŃ–īūįł
ņŤ√ųőńĽĮļģľŔ◊ų“ĶŌĶŃ–īūįł
| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ≤ĽŌÍ Ő‚–Õ£ļĶ•—°Ő‚
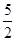 O2(g) == 2CO2(g)£ęH2O(l) ¶§H1£Ĺ-1301.0 kJ?mol-1
O2(g) == 2CO2(g)£ęH2O(l) ¶§H1£Ĺ-1301.0 kJ?mol-1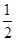 O2(g) == H2O(1) °ųH3 =" -285.8" kJ°§mol-1
O2(g) == H2O(1) °ųH3 =" -285.8" kJ°§mol-1| A£ģ+228.2 kJ°§mol-1 | B£ģ-228.2 kJ°§mol-1 |
| C£ģ+1301.0 kJ°§mol-1 | D£ģ+621.7 kJ°§mol-1 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ≤ĽŌÍ Ő‚–Õ£ļĶ•—°Ő‚
| A£ģ1/3B2H6 (g) + O2 (g) ==1/3B2O3 (g) + H2O (g)°ųH =" -677.7" kJ°§mol-1 |
| B£ģB2H6 (g) + 3O2 (g)="=" B2O3(s) + 3H2O (g)°ųH =" -2165" kJ°§mol-1 |
| C£ģB2H6 (g) + 3O2 (g)="=" B2O3(s) + 3H2O (g)°ųH =" -2033" kJ°§mol-1 |
| D£ģB2H6 (g) + 3O2 (g)== B2O3(s) + 3H2O£®l£©°ųH =" -2165" kJ°§mol-1 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ≤ĽŌÍ Ő‚–Õ£ļĶ•—°Ő‚
| A£ģ2H2O(g) £Ĺ 2H2(g) £ę O2(g)°ųH1 2H2O(l) £Ĺ 2H2(g) £ę O2(g)°ųH2 |
| B£ģS (g) £ę O 2(g) £Ĺ SO2(g)°ųH1 S (s) £ę O 2(g) £Ĺ SO2(g)°ųH2 |
| C£ģ2C (s) £ę O 2(g) £Ĺ 2CO (g)°ųH1 2C (s) £ę 2O 2(g) £Ĺ 2CO2 (g)°ųH2 |
| D£ģH2(g) £ę Cl2(g) £Ĺ 2HCl(g)°ųH1 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ≤ĽŌÍ Ő‚–Õ£ļĶ•—°Ő‚
 O2£®g£©====H2O£®g£© ¶§H1=-Q1 kJ°§mol-1
O2£®g£©====H2O£®g£© ¶§H1=-Q1 kJ°§mol-1| A£ģQ1£ĺQ2 | B£ģQ1=Q2 | C£ģ2Q1£ľQ2 | D£ģ Q2=Q1 Q2=Q1 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ≤ĽŌÍ Ő‚–Õ£ļĶ•—°Ő‚
 H="-24.8" kJ°§mol-1
H="-24.8" kJ°§mol-1 H="-47.2" kJ°§mol-1
H="-47.2" kJ°§mol-1 H="+640.5" kJ°§mol-1
H="+640.5" kJ°§mol-1| A£ģ-218 kJ°§mol-1 | B£ģ-109kJ°§mol-1 | C£ģ+218 kJ°§mol-1 | D£ģ+109 kJ°§mol-1 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ≤ĽŌÍ Ő‚–Õ£ļĶ•—°Ő‚
| A£ģ1£ļ1 | B£ģ3£ļ37 | C£ģ2:1 | D£ģ3:2 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ≤ĽŌÍ Ő‚–Õ£ļĶ•—°Ő‚

| A£ģ¶§H1£Ĺ¶§H2£Ĺ¶§H3£Ĺ¶§H4 | B£ģ¶§H1£ę¶§H2£Ĺ¶§H3£ę¶§H4 |
| C£ģ¶§H1£ę¶§H2£ę¶§H3£Ĺ¶§H4 | D£ģ¶§H1£Ĺ¶§H2£ę¶§H3£ę¶§H4 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ≤ĽŌÍ Ő‚–Õ£ļ Ķ—ťŐ‚

| Ķ—ťīő ż | ∆ū ľő¬∂»t1/°ś | ÷’÷Ļő¬∂»t2/°ś | |
| —őňŠ | NaOH»‹“ļ | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
≤ťŅīīūįłļÕĹ‚őŲ>>
įŔ∂»÷¬–Ň - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com