
分析 (1)As为ⅤA族33号元素,电子排布式为:1s22s22p63s23p63d104s24p3;
(2)同一周期,原子序数越小半径越大,同周期第一电离能从左到右,逐渐增大;
(3)AsCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,由于有一对孤对电子对,分子空间构型为三角锥形;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高;
(5)电负性大的显负价,砷的最低负价为-3价,镓的最高正极为+3价,则砷化镓的化学式为:GaAs,其熔点为1238℃,熔点较高,是以共价键结合形成属于原子晶体.
解答 解:(1)As为ⅤA族33号元素,电子排布式为:1s22s22p63s23p63d104s24p3,简化电子排布式为:[Ar]3d104s24p3,故答案为:[Ar]3d104s24p3;
(2)根据元素周期律,Ga与As位于同一周期,Ga原子序数小于As,故半径Ga大于As,同周期第一电离能从左到右,逐渐增大,故第一电离能Ga小于As,
故答案为:Ga>As;Ga<As;
(3)AsCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,由于有一对孤对电子对,分子空间构型为三角锥形,
故答案为:三角锥形;sp3;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高,
故答案为:GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高;
(5)同周期第一电负性从左到右,逐渐增大,电负性大的显负价,砷的最低负价为-3价,镓的最高正极为+3价,则砷化镓的化学式为:GaAs,GaAs的熔点为1238℃,熔点较高,是以共价键结合形成属于原子晶体,故答案为:GaAs;原子晶体;共价键.
点评 本题考查了分子空间构型、电子排布式、原子杂化方式、电离能及半径大小比较等知识,综合性较强,要求学生有较严谨的态度和扎实的基础,也是对学生能力的考查.


科目:高中化学 来源: 题型:解答题
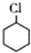 (一氯环己烷)$→_{II}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{II}^{NaOH,乙醇,△}$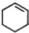 $→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$
$→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$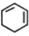

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
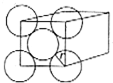 金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:
金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④⑥ | C. | ①②④ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
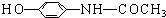 下列关于该物质的描述,不正确的是( )
下列关于该物质的描述,不正确的是( )| A. | 该化合物分子式为C8H9O2N | |
| B. | 能和银氨溶液发生银镜反应 | |
| C. | 能和氢氧化钠发生反应 | |
| D. | 其分子中的原子不可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
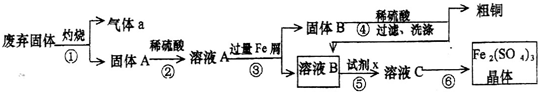
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
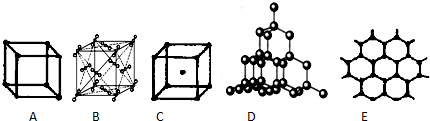
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧:发出白光,生成大量的白色烟雾 | |
| B. | 碳酸钠溶液与氢氧化钙溶液反应:溶液中产生气泡 | |
| C. | 氢气在空气中燃烧:无色气体燃烧,发出淡蓝色火焰,放热 | |
| D. | 镁条在空气中燃烧:银白色固体燃烧,生成白色固体氧化镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com