
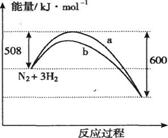
A���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2 2NH3��H=��92kJ��mol��1 2NH3��H=��92kJ��mol��1 |
| B��a�����Ǽ������ʱ�������仯���� |
| C������������û�ѧ��Ӧ�ķ�Ӧ�Ȳ��� |
| D������ͬ�¶ȵ������£��������ͬI��II���������зֱ�ͨ��1mol N2��3 mol H2������I����㶨������II����ɱ䱣�ֺ�ѹ����Ӧ�������������ڵķ�Ӧ����V(I)<V(II) |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ���кͺ�������Һ�ı�����ΪC J/��g.�棩��Ӧǰ���¶�Ϊ18�棬��Ӧ������¶�Ϊt�棬���к��ȵļ���ʽ�ǡ�H=________________________��
���кͺ�������Һ�ı�����ΪC J/��g.�棩��Ӧǰ���¶�Ϊ18�棬��Ӧ������¶�Ϊt�棬���к��ȵļ���ʽ�ǡ�H=________________________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ʱ�Ϊ��ֵ�ķ�Ӧ�������ȷ�Ӧ |
| B�����ȵ������ӷ�Ӧһ�����Է����� |
| C��ͬһ�����£���ˮ�����ʵ���Ũ�Ȳ�ͬ����Һ�У������̶��Dz���ͬ�� |
| D��ǿ����ʶ������ӻ����������ʶ��ǹ��ۻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 �к���Ϊ57.3kJ/mol �������Ȼ�ѧ����ʽ��ȷ����
�к���Ϊ57.3kJ/mol �������Ȼ�ѧ����ʽ��ȷ����| A��HNO3(aq)+KOH(aq)=H2O(l) +KNO3(aq)��H > -57.3kJ/mol. |
B��HNO3(aq)+NH3 ��H2O(aq)=H2O(l) +KNO3(aq)��H <  -57.3kJ/mol. -57.3kJ/mol. |
| C��CH3COOH(aq)+KOH(aq)=H2O(l) + CH3COOK(aq) ��H< -57.3kJ/mol. |
| D��CH3COOH(aq)+ NH3 ��H2O(aq)=H2O(l) + CH3COONH4(aq) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ֲ��Ĺ������ʹ��̫����ת��Ϊ��ѧ�� |
| B������ʹ�������豸�ǽ�����ת��Ϊ���� |
| C����ѧ���Ķ��Ѻ��γ��ǻ�ѧ��Ӧ�������仯����Ҫԭ�� |
| D��ȼ��ȼ��ʱֻ�ǽ���ѧ��ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��16 8O2��18 8O2��Ϊͬ�������壬�������� |
| B��ˮ��վ�ѻ�е��ת��Ϊ���ܣ����˵�վ�ѻ�ѧ��ת���ɵ��� |
| C��������Ư�۳���������ˮ�ľ�����ɱ�����������ߵ�����ԭ����ͬ |
| D��C(ʯī��s)��C(���ʯ��s)��H��0������ʯī���ȶ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com