

分析 除去粗盐中的Ca2+、Mg2+、SO42-,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子.加氢氧化钠和氯化钡无先后顺序要求.洗涤晶体操作用到的是过滤那套装置,蒸发结晶在蒸发皿中进行,注意加热时的操作.
解答 解:(1)除去溶液I中的MgCl2、CaCl2、Na2SO4,应考虑到除杂试不引入新的杂质,所以从提供的试剂中选Na2CO3溶液、NaOH溶液、BaCl2溶液,加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子.加氢氧化钠和氯化钡无先后顺序要求.所以可以有的顺序:BaCl2溶液、Na2CO3溶液、NaOH溶液;NaOH溶液、BaCl2溶液、Na2CO3溶液;BaCl2溶液、Na2CO3溶液、NaOH溶液;故CE正确.
故答案为:CE.
(2)加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子.
故答案为:除尽钙离子和过量的钡离子.
(3)洗涤晶体操作用到的是过滤那套装置,用到的玻璃仪器有:烧杯、漏斗、玻璃棒.
故答案为:烧杯、漏斗、玻璃棒
(4)蒸发结晶在蒸发皿中进行,蒸发皿放于铁架台的铁圈上,倒入液体不超过蒸发皿容积的2/3,加热时不断用玻璃棒搅拌液体防止受热不均,液体飞溅.看到有大量固体析出,或者仅余少量液体时,停止加热,利用余热将液体蒸干.
故答案为:加热时不断用玻璃棒搅拌液体防止受热不均,液体飞溅.看到有大量固体析出,或者仅余少量液体时,停止加热,利用余热将液体蒸干.
点评 本题主要考查了除杂质的原则,以及除杂质的顺序,注意为了将杂质除净,每次所加试剂要过量,不引入新的杂质,这类题时常出现,要加以掌握.物质分离提纯的基本实验操作的考查比较简单.


科目:高中化学 来源: 题型:实验题
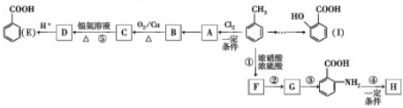
 .
. .写出③的转化关系
.写出③的转化关系 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (用已知中的表达式表示,不用写化学方程式)
(用已知中的表达式表示,不用写化学方程式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
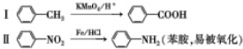
 如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液(已知氯化铵溶液呈酸性),各加入生铁块,放置一段时间.下列有关描述错误的是( )
如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液(已知氯化铵溶液呈酸性),各加入生铁块,放置一段时间.下列有关描述错误的是( )| A. | a中发生了吸氧腐蚀,b中发生了析氢腐蚀 | |
| B. | a中正极反应方程式是:O2+2H2O+4e-═4OH- | |
| C. | a、b试管中生铁块中铁都作电池的负极 | |
| D. | 红墨水在一段时间后,两边液面变为左低右高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g N2O2晶体中阴离子数目为0.2NA | |
| B. | 含1mol NH4Cl和少量NH3•H2O的中性溶液中,NH${\;}_{4}^{+}$数目为NA | |
| C. | 电解精炼铜时,阳极质量减少64g外电路导线上通过的e-数目为NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
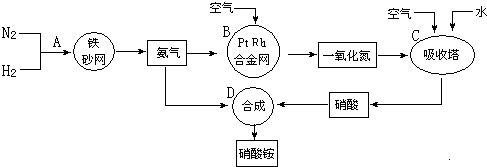
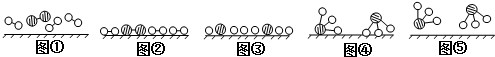
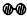 、
、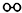 、
、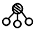 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是阴、阳离子间的静电引力 | |
| B. | 所有金属元素与所有非金属元素间都能形成离子键 | |
| C. | NH4Cl属于离子化合物 | |
| D. | 在离子化合物CaCl2中,两个氯离子间也存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
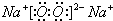 ;B的氢化物的结构式为
;B的氢化物的结构式为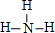 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

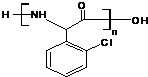 ;D→E所需X物质的结构简式:
;D→E所需X物质的结构简式:
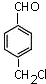 .
.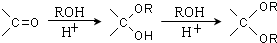
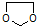 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com