
在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
| c(HI)/mol·L-1 | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
| c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A.0.150 mol·L-1、0.200 mol·L-1
B.0.300 mol·L-1、0.100 mol·L-1
C.0.200 mol·L-1、0.200 mol·L-1
D.0.100 mol·L-1、0.300 mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
粗制的CuSO4·5H2O晶体中含有Fe2+。提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。下列说法不正确的是( )
A.溶解CuSO4·5H2O晶体时要加入少量稀H2SO4
B.加入H2O2,将Fe2+氧化,2Fe2++H2O2+2H+===2Fe3++2H2O
C.由于CuSO4的催化作用,会使部分H2O2分解而损失
D.调溶液 pH=4的依据是Cu(OH)2比Fe(OH)3更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。回答下列问题:
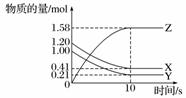
(1)从反应开始到10 s时,v(Z)=________________________________________________。
(2)反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是( )
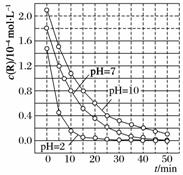
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间, pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A.v(O2)=0.001 mol·L-1·s-1
B.v(NH3)=0.01 mol·L-1·s-1
C.v(NO)=0.001 mol·L-1·s-1
D.v(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题。
(1)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)4NH3(g)+3O2(g)
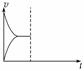
常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2 mol N2,请在右图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
(2)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
| 活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________ mol·L-1·min-1;当活性炭消耗0.015 mol 时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(3)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0
某科学实验小组将6 mol CO2和8 mol H2充入一容积为 2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
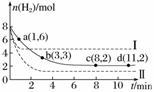
①该反应在0~8 min内CO2的平均反应速率是________ mol·L-1·min-1。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线 Ⅰ 改变的条件可能是________,曲线 Ⅱ 改变的条件可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
稀氨水中存在着下列平衡:NH3·H2ONH +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥
C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是( )
A.溶液的体积10V甲<V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH :甲≤乙
查看答案和解析>>
科目:高中化学 来源: 题型:
由Ca3(PO4)2 、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
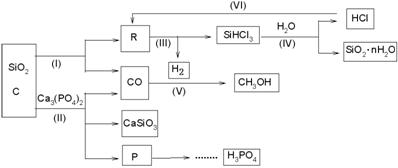
(1)上述反应中,属于置换反应的是 [选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]
(2)高温下进行的反应Ⅱ的化学方程式为: ;
固体废弃物CaSiO3可用于 。
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是 。
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 。
(5)指出(VI)这一环节在工业生产上的意义
(6)写出由P→H3PO4 有关反应式
①
②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com