
【题目】已知反应①2BrO3-+Cl2=Br2+2ClO3-;②5Cl2+I2+6H2O=2HIO3+10HCl;③ClO3-+5Cl-+6H+=3Cl2+3H2O。下列物质氧化能力强弱顺序正确的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮的氧化物等,带来严重的环境污染。煤干馏是提高煤利用率、生产重要化工原料、降低污染物排放量的有效措施之一。
某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如下,请回答有关问题:
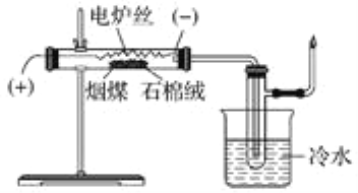
(1)煤干馏的条件是________________________________________________________
(2)盛有冷水的烧杯的作用是________________________________________________。
(3)实验后检验生成粗氨水的操作是_________________________________________。
(4)已知一氧化碳不能使溴水褪色,若将具支试管出来的气体通入溴水中,发现溴水褪色,则说明产生了_____________________________________________________________。
(5)检验具支试管出来的气体的性质后,将尾气点燃,火焰的颜色为______________。
(6)从煤焦油中分离出苯及其同系物的实验方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
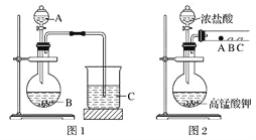
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】该装置为锂钒氧化物二次电池,其成本较低,对环境无污染:![]() 在下图中用该电池电解含镍酸性废水可得到单质镍(已知:
在下图中用该电池电解含镍酸性废水可得到单质镍(已知:![]() )。下列说法不正确的是( )
)。下列说法不正确的是( )
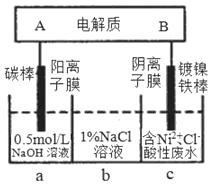
A.该电池充电时,A电极的电极反应式为![]()
B.电解过程中,b中NaCl溶液的物质的浓度会增大
C.当锂钒氧化物二次电池中有7gLi参与放电时,一定能得到29.35g镍
D.锂钒氧化物二次电池一般用非水溶液作为电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与足量很稀的硝酸充分反应,反应过程中无气体放出,在反应结束后的溶液中逐滴加入5mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
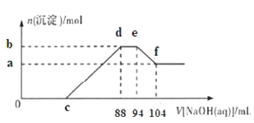
A.硝酸的还原产物全部是![]() B.b点与a点的差值为0.05mol
B.b点与a点的差值为0.05mol
C.原硝酸溶液中硝酸的物质的量为0.47molD.样品中铝粉和铁粉的物质的之比为5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要金属,Cu及其化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)CuSO4可由金属铜与稀硫酸并通入氧气反应制备,该反应的化学方程式为_______;
(2)无水CuSO4粉末常用来检验一些有机物中的微量水分,现象是________________;
(3)![]() 的立体构型是________,其中S原子的杂化轨道类型是_______;
的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为__________(填“密置层”、“非密置层”),金原子的配位数为__________;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,该晶体储氢后的化学式应为___________。若Cu原子与Au原子的距离为a cm,则该晶体储氢后的密度为_________。(含a的表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)合成氨反应。
已知,氨的分解反应:2NH3(g) N2(g)+3H2 (g),活化能Ea=600kJmol-1,合成氨有关化学键的键能如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
则合成氨反应:![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)的活化能Ea=________。
H2(g)NH3(g)的活化能Ea=________。
(2)已知2NO+O2=2NO2反应历程分两步
方程式 | 活化能 | 焓变 | |
总反应 | 2NO(g)+O2(g)=2NO2(g) |
| △H<0 |
第一步(快速平衡) | 2NO(g)N2O2(g) | Ea1 | △H1 |
第二步(慢反应) | N2O2(g) +O2(g)=2NO2(g) | Ea2 | △H2 |
①平衡常数K可用气体分压来表示,即K的表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:![]() ),某一时刻第一步达到平衡,写出第一步反应的平衡常数
),某一时刻第一步达到平衡,写出第一步反应的平衡常数![]() ________(用
________(用![]() 和各气体的物质的分数来表示)。
和各气体的物质的分数来表示)。
②用NO表示总反应的速率方程为![]() ;NO2表示的总反应速率方程为
;NO2表示的总反应速率方程为![]() ,
,![]() 与
与![]() 是速率常数,则
是速率常数,则![]() ________。
________。
③下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是________。
A.![]() B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
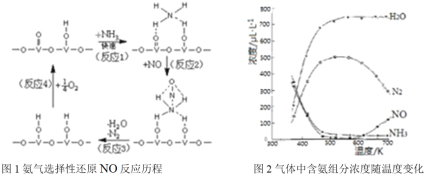
①用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示,请写出图1中所示的总反应方程式_______,该反应的含氮气体组分随温度变化如图2所示,当温度大于600K时,可能发生副反应的化学方程式_________。
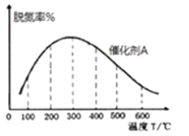
②在有催化剂的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如下图所示,其他条件相同时,请在图中补充在无催化剂作用下脱氮率随温度变化的曲线______________。
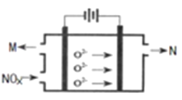
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如下图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电解质溶液电导率越大导电能力越强。常温下用![]() 溶液分别滴定
溶液分别滴定![]() 浓度均为
浓度均为![]() 的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
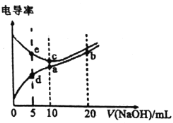
A.c点的混合液pH=7
B.e、d两点溶液混合后的溶液中:![]()
C.b点溶液中:![]()
D.a、b、c三点溶液中水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com