
| A. | $\frac{1}{22.4}$mol/L | B. | $\frac{1}{36.5}$mol/L | C. | $\frac{4}{5}$×$\frac{1}{22.4}$mol/L | D. | 无法计算 |
分析 设混合气体中含有xmolHCl,ymolN2,进行喷泉实验时,氯化氢溶于水,得到的为盐酸溶液,HCl的体积等于溶液的体积,以此可计算溶液浓度.
解答 解:设混合气体中含有xmolHCl,ymolN2,则HCl的体积为22.4xL,而只有氯化氢溶于水,得到溶液为盐酸溶液,且溶液的体积即等于HCl的体积.
则溶质物质的量浓度为:$\frac{xmol}{22.4xL}$=$\frac{1}{22.4}$mol/L,
故选A.
点评 本题考查物质的量浓度的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握相关计算公式的运用,关键是判断HCl的体积和溶液的体积相等,故没有必要去计算混合气体中HCl和氮气的比例,难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol/L | B. | 0.015 mol/L | C. | 0.017 mol/L | D. | 0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
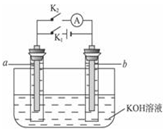 如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| B. | 断开K2,闭合K1一段时间,溶液的pH要变大 | |
| C. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的单晶硅用于制造光导纤维和登月车的光电池 | |
| B. | 石油裂解的主要目的是为了获得短链不饱和烃 | |
| C. | 按照分散质和分散剂所处的状态,可分为9种分散系 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
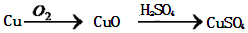 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com