
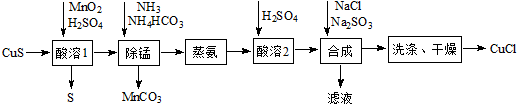
分析 以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线为:在酸溶1步骤中,硫酸溶液中加入二氧化锰、硫化铜,发生氧化还原反应生成硫单质,二氧化锰被还原为二价锰离子留在溶液中;然后在除锰步骤中,二价锰离子转化为碳酸锰沉淀,溶液中CuSO4转变为[Cu(NH3)4]CO3留在溶液中,蒸氨步骤中[Cu(NH3)4]CO3发生分解反应得到CuO固体、氨气与二氧化碳,再用硫酸溶解CuO得到CuSO4,在合成步骤中,氯化钠、亚硫酸钠、硫酸铜反应生成氯化亚铜和硫酸钠和硫酸,再经过过滤、洗涤、干燥得到氯化亚铜,洗涤沉淀时,为减少CuCl溶解损失,根据溶解平衡,先用盐酸洗涤,再用乙醇洗涤,据此解答.
解答 解:(1)酸溶1和除锰过程为:硫酸溶液中加入二氧化锰、硫化铜,发生氧化还原反应生成硫单质,二氧化锰被还原为二价锰离子留在溶液中;然后在除锰步骤中,二价锰离子转化为碳酸锰沉淀,可知:锰元素化合价降低,所以二氧化锰做氧化剂;
故答案为:氧化剂;
(2)依据除锰过程可知:溶液中加入氨气、碳酸氢铵,与溶液中的二价锰离子反应生成碳酸锰和铵根离子,方程式:Mn2++HCO3-+NH3=MnCO3↓+NH4+;
故答案为:Mn2++HCO3-+NH3=MnCO3↓+NH4+;
(3)气体的溶解度随着压强的增大而增大,所以减小压强有利于氨气的逸出;
故答案为:减压有利于气体逸出;
(4)在合成步骤中,氯化钠、亚硫酸钠、硫酸铜反应生成氯化亚铜和硫酸钠和硫酸,方程式为:2NaCl+Na2SO3+2CuSO4+H2O=2CuCl+2Na2SO4+H2SO4;
故答案为:2NaCl+Na2SO3+2CuSO4+H2O=2CuCl+2Na2SO4+H2SO4;
(5)将合成步骤的NaCl与Na2SO3换为NH4Cl 和(NH4)2SO3,滤液中含有硫酸铵、硫酸,可获得一种可用作氮肥的副产品,可能为:(NH4)2SO4[或NH4HSO4、(NH4)2SO4和NH4HSO4、(NH4)2SO4和H2SO4等];
故答案为:(NH4)2SO4[或NH4HSO4、(NH4)2SO4和NH4HSO4、(NH4)2SO4和H2SO4等];
(6)氯化亚铜存在沉淀溶解平衡:CuCl(s) Cu+(aq)+Cl-(aq),洗涤氯化亚铜时,为避免氯化亚铜因溶解而损坏,所以应先用盐酸洗涤,然后用乙醇洗涤;CuCl发生水解的化学方程式为CuCl+H2O?CuOH+HCl,
故答案为:稀盐酸;CuCl+H2O?CuOH+HCl.
点评 本题通过氯化亚铜制备的工艺流程考查了铜及其化合物的性质,准确把握工艺流程是解题关键,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
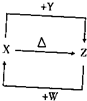
| A. | 在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量 | |
| B. | 反应达到最大限度时,加入X,反应的△H增大 | |
| C. | 反应速率υ正(X)=$\frac{m}{n}$υ正(Y) | |
| D. | 降低温度,反应的速率值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将Cl2通入NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 铜和稀硝酸的反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 钢铁吸氧腐蚀的正极反应:4OH--4e-═O2↑+2H2O | |
| D. | 将少量SO2通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com