
 某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去).
某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去).| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
分析 (1)①实验室使用电石与水的反应制取乙炔;
②检验可燃气体纯度的操作方法:收集一试管气体,用拇指堵住试管口移近火焰点燃,若发出轻微响声,证明气体比较纯净;
③乙炔燃烧的现象:火焰明亮并伴有浓烈的黑烟;
(2)①读数时,要保持装置A和装置B液面相平,这样得到的数据比较准确;
②根据醇与氢气的物质的量关系确定醇的种类.
解答 解:(1)①实验室使用电石与水的反应制取乙炔,化学反应方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
②检验可燃气体纯度的操作方法:收集一试管气体,用拇指堵住试管口移近火焰点燃,若发出轻微响声,证明气体比较纯净,
故答案为:收集一试管气体,用拇指堵住试管口移近火焰点燃,若发出轻微响声,证明气体比较纯净;
③乙炔含碳量非常高,燃烧时:火焰明亮并伴有浓烈的黑烟,
故答案为:火焰明亮并伴有浓烈的黑烟;
(2)①读数时,要保持装置A和装置B液面相平,这样得到的数据比较准确,
故答案为:保持装置A和装置B液面相平;
②由实验1数据可知,△V(氢气)=264-40=224mL,n(氢气)=$\frac{224×10{\;}^{-3}L}{22.4L/mol}$=0.01mol,n(醇)=$\frac{0.62g}{62g/mol}$=0.01mol,故n(醇):n(氢气)=0.01:0.01=1:1,故该醇含有两个羟基,为二元醇,
故答案为:二.
点评 本题考查乙炔气体的制备原理及性质、可燃气体的验纯、气体制备原理、量气管的操作、有关醇的物质的量的计算等知识点,注意基础的熟练掌握,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
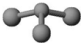 甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系:甲+H2O→丙+丁
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系:甲+H2O→丙+丁 H++AlO2-+H2O.
H++AlO2-+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3CH(NH2)CH2COOH 3-氨基丁酸 | ||
| C. | 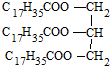 硬脂酸甘油脂 硬脂酸甘油脂 | D. | 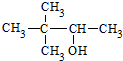 2,2-二甲基-3-丁醇 2,2-二甲基-3-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com