
分析 (1)①通过已知:(i)C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
(ii)CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
计算反应C(s)+H2O(g)?CO(g)+H2(g)的△H,反应△S>0,根据△G=△H-T•△S<0反应自发进行分析;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①平衡常数等于生成物平衡浓度系数次幂之积和反应物平衡浓度系数次幂之积的比值;
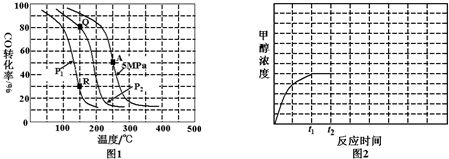
②150℃时,比较Q和R两点对应的CO的转化率的大小,得出平衡移动的方向,从而判断压强的改变;Kp只受温度的影响;
③反应(ii)CO(g)+2H2(g)?CH3OH(g)△H<0,t2时降低温度,平衡正向移动,甲醇的浓度增大,直至t3时达到新的平衡时保持不变.
解答 解:(1)①已知:(i)C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
(ii)CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
根据盖斯定律可知i+ii得C(s)+H2O(g)=CO(g)+H2(g)△H=+172.5kJ•mol-1-41.0kJ•mol-1=+131.5kJ•mol-1>0,反应S>0,高温时G=△H-T•△S<0反应自发,故答案为:高温;
②A.混合气体的密度不变等于质量和体系体积的比值,反应前后气体的质量变化,体积不变,所以密度变化,密度不变的状态是平衡状态,故正确;
B.反应前后气体的物质的量变化,当该容器内气体的总压强不变的状态是平衡状态,故正确;
C.相同时间内生成H2的量与消耗了的 H2O 的量相等,不能说明正逆反应速率相等,不一定平衡,故错误;
D.CO的体积分数不变的状态是平衡状态的特征之一,故正确.
故选ABD;
(2)①反应(ii)平衡常数表达式:Kc=$\frac{[C{H}_{3}OH]}{[CO]•[{H}_{2}]^{2}}$,故答案为:$\frac{[C{H}_{3}OH]}{[CO]•[{H}_{2}]^{2}}$;
②150℃时,Q点比R点对应的CO的转化率大,平衡正向移动CO的转化率增大,而压强增大,CO(g)+2H2(g)?CH3OH(g)的平衡正向移动,说明P1>P2;Kp只受温度的影响,Q点和R点对应的温度都是150℃,因此Kc(Q)=Kc(R),
故答案为:小于;等于;
③反应(ii)CO(g)+2H2(g)?CH3OH(g)△H<0,t2时降低温度,平衡正向移动,甲醇的浓度增大,直至t3时达到新的平衡时保持不变,对应的图象为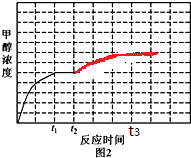 ,故答案为:
,故答案为: .
.
点评 本题考查了化学反应进行的方向和化学平衡,综合性较强,难度较大,题材背景新,侧重于学生对化学反应原理、变通能力的考查.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | C. | 反应物 | D. | 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
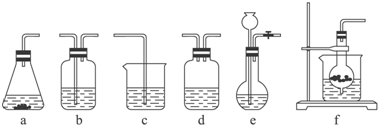
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | c | ||
| 选择的药品(填序号) | ① |
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是共价化合物 | |
| B. | SiO2可用于制光导纤维,干冰可用于人工降雨 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | 都是酸性氧化物,都能与强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后pH>7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol/L | |
| C. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 | |
| D. | 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:E>F>C>D | |
| B. | 分子AC2中各原子最外层均满足8电子结构 | |
| C. | 由D、F组成的盐溶液蒸干后可以得到原溶质 | |
| D. | 元素B的最高价氧化物对应的水化物与其氢化物可以反应生成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸、氢氧化钠溶液能导电,所以它们都是电解质 | |
| B. | 电解质溶液通电时,电解质才能发生电离 | |
| C. | 水溶液能导电的化合物不一定是电解质 | |
| D. | 难溶物质肯定不是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com