
现有三种元素的基态原子的电子排布式如下:① 1s22s22p63s23p1;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:①>②>③ | D.最高正化合价:③>②>① |
A
解析试题分析:由核外电子排布式可知,①1s22s22p63s23p1为Al元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素。A、同周期自左而右,第一电离能增大,即P元素的第一电离能大于Al元素的。F元素的非金属性强于P元素,因此F元素的第一电离能大于P元素的,即第一电离能:③>②>①,A正确;B、同周期自左而右,原子半径减小,同主族自上而下原子半径增大,故原子半径Al>P>F,即①>②>③,故B错误;C、同周期自左而右,电负性增大,同主族自上而下降低,故电负性③>②>①,故C错误;D、Al元素最高正化合价为+3,P元素最高正化合价为+5,F没有正化合价,故最高正化合价:②>①>③,故D错误,答案选A。
考点:考查核外电子排布、电离能、电负性、原子半径以及化合价判断


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:单选题
图中a、b、c、d、e、f为元素周期表中前4周期的一部分元素,下列有关叙述正确的是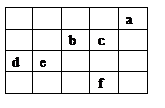
| A.b、c、e三种元素的原子半径大小关系:e>c>b |
| B.六种元素分别形成的单质固体中,d的熔、沸点最高 |
| C.c的氢化物沸点比f的氢化物沸点低 |
| D.b元素除0价外,只有一种化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是
A.元素B和E的氧化物对应的水化物均为强酸
B.C的单质能与A的氧化物发生置换反应
C.元素C、D、E的最高价氧化物对应的水化物之间均可相互反应
D.工业上常用电解元素C、D的氯化物来制取它们的单质
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于卤素(F、Cl、Br、I)的化学性质的叙述,错误的是
| A.随原子序数逐渐增大,单质跟水的反应能力逐渐减弱 |
| B.随原子序数逐渐增大,单质的氧化性逐渐减弱 |
| C.将氯水加到KI-淀粉溶液中,溶液变蓝 |
| D.随原子序数逐渐增大,氢化物的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列比较中正确的是
| A.金属性:Mg>Al>Na | B.原子半径:S>O>F |
| C.碱性:KOH>Mg(OH)2>NaOH | D.氢化物的稳定性:HBr>HCl>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实中,不能用于判断元素失电子能力强弱的是
| A.金属间发生的置换反应 |
| B.金属元素的最高价氧化物对应水化物的碱性强弱 |
| C.金属元素的单质与水或酸反应置换出氢气的难易 |
| D.每摩尔金属单质在反应中失去电子数目的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X.Y.Z.W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原予最外层只有2个电子,Z单质可制成半导体材料,W写X属于同一主族。下列叙述正确的是
| A.元素X的简单气态氢化物的热稳定性最弱 |
| B.元素W的最高价氧化物对应水化物的酸性比Z弱 |
| C.原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
| D.化合物YX、ZX2、 WX3中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于8939Y的说法不正确的是( )
| A.属于金属元素 |
| B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 |
| D.8939Y和9039Y是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
 YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com