
 ,用电子式表示X与R化合物的形成过程
,用电子式表示X与R化合物的形成过程
分析 X、Y、Z、W、R 5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,据此解答.
解答 解:(1)Z在Y单质中燃烧的产物为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ;硫化氢为共价化合物,分子中存在两个H-S键,用电子式表示其形成过程为
;硫化氢为共价化合物,分子中存在两个H-S键,用电子式表示其形成过程为 ,
,
故答案为: ;
; ;
;
(2)电子层数越多,微粒半径越大,故S2-的半径大于O2-、Na+、Al3+的半径,而当电子层数相同时,核电荷数越多,半径越小,故半径O2->Na+>Al3+,故有:S2->O2->Na+>Al3+,故答案为:S2->O2->Na+>Al3+;
(3)W单质即为Al单质,与Z的最高价氧化物对应的水化物即NaOH反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
W单质即Al与R的最高价氧化物对应的水化物即H2SO4反应的化学方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑;
故答案为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度中等,注意半径比较规律与电子式的书写.


科目:高中化学 来源: 题型:解答题

 ;D的最简式CH2;
;D的最简式CH2; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应.
+HBr,其反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第I A族元素都是碱金属元素 | |
| B. | 元素周期表中有18个纵行,所以有18个族 | |
| C. | 可以从过渡金属中寻找新型催化剂 | |
| D. | 主族元素的金属元素原子最外层电子数一定小于或等于4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
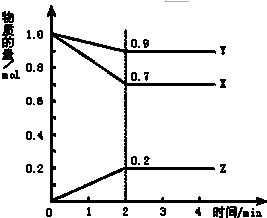 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③⑥ | C. | ②④⑤⑥ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 从Z导管出来的气体中无二氧化碳 | |
| C. | 洗气瓶中产生的沉淀是碳酸钡和硫酸钡的混合物 | |
| D. | 在导管中有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Joseph John Thomson | B. | Ernest Rutherford | ||
| C. | Justus von Liebig | D. | Jons Jakob Berzelius |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
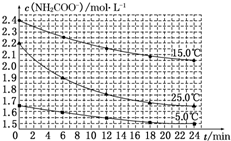 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com