
【题目】请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________。
(2)广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是 ___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -b kJ/mol
③ H2O(g)= H2O(l) ΔH3 = -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______。
A.HCN B.HClO C.CH3COOH D.H2CO3
【答案】BO2-+2H2O![]() H3BO3+OH- ② 2CH3OH(l)+2O2=2CO+4H2O(l) H=-(a+4c-b)kJ/mol CO32- C
H3BO3+OH- ② 2CH3OH(l)+2O2=2CO+4H2O(l) H=-(a+4c-b)kJ/mol CO32- C
【解析】
(1)NaBO2是强碱弱酸盐,BO2-水解,溶液呈碱性;
(2)根据水解后不出现元素化合价的变化分析;
(3)根据盖斯定律计算甲醇不完全燃烧生成一氧化碳和液态水的焓变;
(4)同浓度的强碱弱酸盐,弱酸根离子水解程度越大,溶液碱性越强;酸性越强,加水稀释相同倍数,pH变化越大;
(1)BO2-水解,NaBO2溶液呈碱性,水解的离子方程式是BO2-+2H2O![]() H3BO3+OH-;
H3BO3+OH-;
(2)①BaO2的水解产物是Ba(OH)2和H2O2,各元素化合价不变,故不选①;
②PCl3中P元素化合价是+3价、Cl元素化合价是-1价, HClO中Cl元素化合价是+1价,PH3中P元素化合价是-3价,化合价有变化,故选②;
③CaC2水解的产物是Ca(OH)2和C2H2 ,各元素化合价不变,故不选③;
④Al2S3水解的产物是Al(OH)3和H2S,各元素化合价不变,故不选④;
⑤TiCl4水解产物是TiO2·xH2O和HCl,各元素化合价不变,故不选⑤;
(3) ① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -b kJ/mol
③ H2O(g)= H2O(l) ΔH3 = -c kJ/mol
根据盖斯定律①+③×4-②得2CH3OH(l)+2 O2=2CO+4H2O(l) H=-(a+4c-b)kJ/mol;
(4)同浓度的五种钠盐溶液,Na2CO3溶液pH最大,说明CO32- 水解程度最大,CO32-结合H+能力最强;
根据表中数据,可知酸性:CH3COOH >H2CO3>HClO >HCN,所以浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是CH3COOH,选C。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】温度为T0时,在容积固定的密闭容器中发生 ![]() 未配平
未配平![]() 反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为
反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为 ![]() 、
、![]() 时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
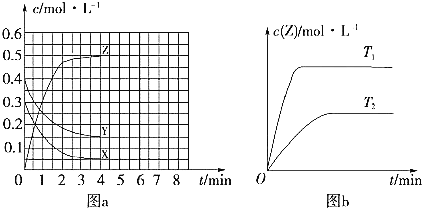
A.发生反应时,各物质的反应速率大小关系为![]()
![]() v
v![]()
B.图a中反应达到平衡时,Y的转化率为![]()
C.![]() 时,该反应的平衡常数为
时,该反应的平衡常数为![]()
D.该反应正反应的反应热![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变。
①能说明反应N2(g)+3H2(g) ![]() 2NH3(g)达到平衡状态的有__;
2NH3(g)达到平衡状态的有__;
②能说明反应H2(g)+I2(g) ![]() 2HI(g)达到平衡状态的有__;
2HI(g)达到平衡状态的有__;
(2)为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。


①化学反应速率最快的时间段是___(填选项),影响此时间段反应速率的主要因素是___;
A.O~t1 B.t1~t2 C.t2~t3 D.t3~t4
②为了减缓上述反应速率,欲向盐酸中加入下列物质,你认为可行的有___;
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中可进行反应A+B![]() C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是
C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是

A. 该反应是吸热反应
B. 反应速率最大的时间段是在t1~t2
C. 四个时间段内生成C的量最多的是t1~t2
D. 反应速率后来减慢主要是受反应物浓度变化的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置如图所示,且它们的质子数之和为32。D元素原子的最外层电子数为次外层电子数的2倍。下列说法正确的是

A.原子半径:D>A>CB.常温常压下,B单质为固态
C.气态氢化物热稳定性:B>CD.C的最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:

(1)在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g) △H =-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+ H2O(g) △H =-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①氢气的转化率=__________________;
②该反应的平衡常数为___________(保留小数点后2位);
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
④当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1______c2的关系(填>、<、=)。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
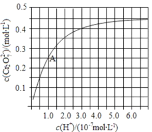
(3)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72) 随c(H+)的变化如图所示。①离子方程式表示Na2CrO4溶液中的转化反应_________________。②由图可知,溶液酸性增大,CrO42的平衡转化率____(填“增大“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol,
②![]()
![]() ,
,
③![]()
![]()
则表示氢气燃烧热的热化学方程式为________。
(2)判断下列反应的熵值是增大、减小还是几乎不变。
①2H2(g)+O2(g)=2H2O(l);熵 ________(填“增大”“减小”“几乎不变”,下同)
②H2(g)+Cl2(g)=2HCl(g);熵________
③(NH4)2CO3(g)=NH4HCO3(g)+NH3(g);熵________
④Cu(s)+Cl2(g)=CuCl2(s);熵________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的操作、现象和结论(或解释)均正确的是( )
操作 | 现象 | 结论(或解释) | |
A | 向某溶液中滴加Ba(NO3)2溶液和稀盐酸 | 生成白色沉淀 | 原溶液中有SO42- |
B | 密闭容器中有反应:A(g)+B(g) | 再次达到平衡时测得c(C)为0.8mol·L-1 | x=l,增大压强平衡正向移动 |
C | 往试管中加入2mL 10%的CuSO4溶液,再滴入4~6滴2%的NaOH溶液,振荡后加入2mL葡萄糖溶液,加热煮沸 | 产生砖红色沉淀 | 葡萄糖分子结构中有醛基 |
D | 向某溶液中滴加新制氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液说法正确的是 ( )
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
B.向 NaF 溶液中滴加硫酸至中性时,2c(![]() )=c(HF)
)=c(HF)
C.向氨水中加入 NH4Cl 固体,溶液中![]() 增大
增大
D.pH=a 的氨水,稀释至原体积的 10 倍后,其 pH=b,则 b<a-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com