
| A. | ②④①⑤⑥ | B. | ②④①⑥⑤ | C. | ①③④②⑤ | D. | ①③④②⑥ |
分析 以氯乙烷为原料制取乙二酸(HOOC-COOH),应先发生消去反应生成乙烯,再与氯气加成得到1,2-二氯乙烷,然后水解、氧化可得到乙二酸,以此来解答.
解答 解:以氯乙烷为原料制取乙二酸(HOOC-COOH),其步骤为:
②与NaOH的醇溶液共热发生消去反应生成乙烯;
④在催化剂存在情况下与氯气加成得到1,2-二氯乙烷;
①与NaOH的水溶液共热得到乙二醇;
⑤在Cu或Ag存在的情况下与氧气共热氧化为乙二醛;
⑥与新制的Cu(OH)2共热氧化为乙二酸;
即步骤为②④①⑤⑥,
故选A.
点评 本题考查有机物的合成,为高频考点,侧重于学生的分析能力的考查,熟悉有机物的官能团、性质是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 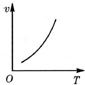 | B. | 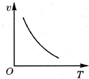 | C. | 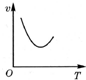 | D. | 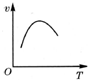 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
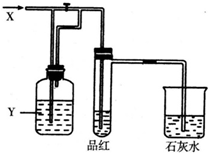 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )| ① | ② | ③ | ④ | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和的NaHCO3溶液 | 浓硫酸 | Na2SO3溶液 | Na2CO3溶液 |
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子由锌经外电路流向氧化银 | |
| B. | 该电池可实现化学能和电能的相互转化 | |
| C. | 锌是负极,氧化银是正极 | |
| D. | 工作时,负极区溶液pH减小,正极区pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
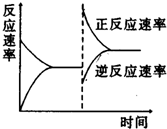
| A. | 升高温度,同时加压 | |
| B. | 降低温度,同时减压 | |
| C. | 增大反应物浓度,同时减小生成物浓度 | |
| D. | 增大反应物浓度,同时升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
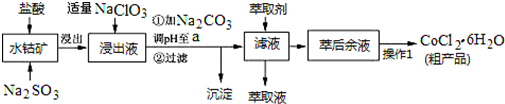
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
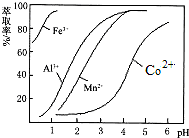
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu、Fe | B. | K、Na | C. | Cu、Al | D. | Zn、Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com