
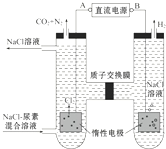
| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
分析 该装置是电解池,生成氢气的电极得电子发生还原反应为阴极,连接阴极的电极B为负极,则A为正极,生成氮气的电极为阳极,阳极室反应为6Cl--6e-═3Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,阴极反应式为2H2O+2e-=H2↑+2OH-,电子从负极流向阴极、阳极流向正极,据此分析解答.
解答 解:该装置是电解池,生成氢气的电极得电子发生还原反应为阴极,连接阴极的电极B为负极,则A为正极,生成氮气的电极为阳极,阳极室反应为6Cl--6e-═3Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,阴极反应式为2H2O+2e-=H2↑+2OH-,电子从负极流向阴极、阳极流向正极,
A.通过以上分析知,B为电极负极,故A错误;
B.阴极反应为:6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑)阳极反应为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,故B错误;
C.电子从负极流向阴极、阳极流向正极,所以电子移动的方向是B→右侧惰性电极,左侧惰性电极→A,电子不会经过溶液,故C错误;
D.通过以上分析知,阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高考高频点,会根据生成气体成分确定阴阳极、正负极,正确书写电极反应式是解本题关键,注意电子不加入电解质溶液,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | 往某溶液中滴加BaCl2溶液,产生白色沉淀,则原溶液中一定含SO42- | |
| B. | 往某溶液中滴加稀硝酸酸化的硝酸银溶液,产生白色沉淀,则原溶液中一定含Cl- | |
| C. | 取某溶液进行焰色反应,透过蓝色钴玻璃焰色为紫色,则原溶液的溶质一定是钾盐 | |
| D. | 往某溶液中通入CO2,产生白色沉淀,则原溶液中一定含SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
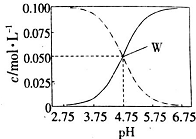 室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )
室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )| A. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO)>c(H+)+c(OH-) | |
| B. | 向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l | |
| D. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
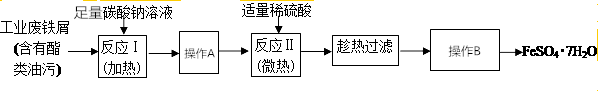
 HCO3-+OH-,溶液呈碱性,酯在碱性条件下完全水解(结合离子方程式解释),反应Ⅰ需要加热,其原因是升高温度,促进水解,溶液碱性增强,使反应充分进行.
HCO3-+OH-,溶液呈碱性,酯在碱性条件下完全水解(结合离子方程式解释),反应Ⅰ需要加热,其原因是升高温度,促进水解,溶液碱性增强,使反应充分进行.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
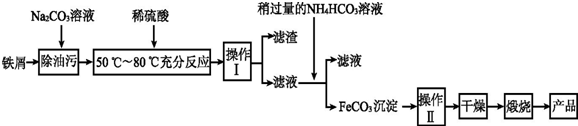
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
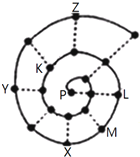 如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )
如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )| A. | Y元素对应的氢化物比Z元素对应的氢化物更稳定 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | M、K元素的离子半径大小顺序是M2+>K2- | |
| D. | 由K、L两种元素组成的化合物中不可能含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com