


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
209 83 |
210 83 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O |
| C、向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| D、氯气通入水中:Cl2+H2O?H++HClO+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3的电离:NaHCO3?HCO3-+Na+ |
| B、CH3COONH4的电离:CH3COONH4=NH4++CH3COO- |
| C、Na2S的水解:S2-+2H2O?H2S+2OH- |
| D、FeCl3的水解:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、480 mL、117g |
| B、500mL、58.5g |
| C、480 mL、58.5 g |
| D、500mL、117g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) |
| B、实验①反应后的溶液中:c(OH-)=c(H+)+c(HA) |
| C、实验②反应后的溶液中:c(A-)+c(HA)>0.2 mol/L |
| D、实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
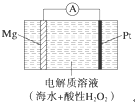 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )| A、电池的负极反应为Mg-2e-═Mg2+ |
| B、电池工作时,H+向负极移动 |
| C、电池工作一段时间后,溶液的pH增大 |
| D、电池总反应式是Mg+H2O2+2H+═Mg2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com