
【题目】石灰石是一种化工原料,可以通过反应生成一系列物质,如图:

下列说法正确的是
A.漂粉精是混合物,有效成分是氯化钙
B.图示的制纯碱方法,要求先向饱和食盐水中通NH3,然后再通CO2
C.工业制漂粉精通常用氯气通入澄清石灰水中
D.制取纯碱和漂粉精所涉及的反应都是非氧化还原反应
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
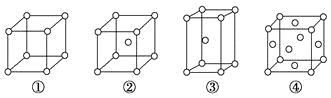
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3应用广泛,水处理中常用作还原剂、冶金中常用作络合剂。
(1)Na2S2O3的实验室制法:装置如图(加热和夹持装置略):

已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中发生反应的化学方程式为______。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3。一段时间后,乙中再次出现少量浑浊,此时须立刻停止通入SO2。结合离子方程式解释此时必须立刻停止通入SO2的原因:______。

③丙中,NaOH溶液吸收的气体可能有______。
(2)实际工业生产中制得的Na2S2O3溶液中常混有少量Na2SO3,结合溶解度曲线(如图),获得Na2S2O35H2O的方法是______。
(3)Na2S2O3的用途:氨性硫代硫酸盐加热浸金是一种环境友好的黄金(Au)浸取工艺。
已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在碱性较强时受热会生成CuO沉淀。
①将金矿石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反应的原理为:
i.Cu(NH3)42+ + Au + 2S2O32![]() Cu(NH3)2+ + Au(S2O3)23+ 2NH3
Cu(NH3)2+ + Au(S2O3)23+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH
浸金过程Cu(NH3)42+起到催化剂的作用,金总反应的离子方程式为:______。

② 一定温度下,相同时间金的浸出率随体系pH变化曲线如如图,解释pH>10.5时,金的浸出率降低的可能原因_______。(写出2点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池为______(填原电池、电解池或电镀池),通入甲醇电极的电极反应式为________。
(2)乙池中B电极为______(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为________。
(3)当乙池中B极质量增重5.4g时,甲池中理论上消耗O2的体积为______mL(标准状况)。
(4)丙池中,C上的电极反应式为________________。如果起始时盛有1000 mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____(填物质名称),其质量约为_______g。
(5)若将丙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6g甲醇时,丙中两个电极质量差为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁和铜的固体混合物在空气中部分生锈(锈的成分为 CuO 和 Fe2O3),其总质量为 6.4 g,某实验小组对此固体混合物进行实验探究。

(1)操作 1 的名称为_____,此操作使用的玻璃仪器有_____、_____、_____。
(2)固体混合物中两种氧化物与稀硫酸反应的离子方程式为_____、_____。
(3)红色固体滤渣为_____(填“铜”或“氧化铁”)。
(4)查阅资料知 Cu+Fe2(SO4)3![]() CuSO4+2FeSO4,说明在浅绿色强酸性溶液中___________ (填“含”或“不含”)Fe2(SO4)3。
CuSO4+2FeSO4,说明在浅绿色强酸性溶液中___________ (填“含”或“不含”)Fe2(SO4)3。
(5)“一系列操作”中,其中有一步反应如下,请将此反应方程式配平:
_____Fe(OH)2+_________O2+_____H2O![]() _____Fe(OH)3
_____Fe(OH)3
(6)通过进一步实验得出:浅绿色溶液中不含 Cu2+,则原部分生锈的固体混合物中氧元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是

A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铜与稀硝酸反应产生NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
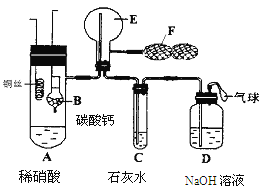
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是________________________ __。
(5)装置D的作用是_________ ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
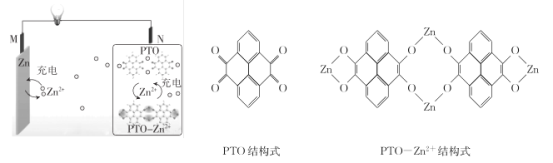
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(g)![]() 2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压B.减压C.减小E的浓度D.降温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com