
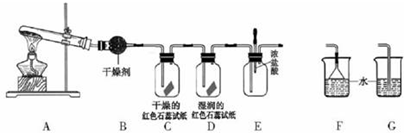
分析 (1)实验室用氯化铵与氢氧化钙反应制备氨气;
(2)氨气为碱性气体,应选择碱性干燥剂;
(3)根据方程式计算;
(4)氨气密度小于空气,应采用向下排气法收集;
(5)氨气能使湿润的红色石蕊试纸变蓝;
(6)氨气与挥发的HCl会生成白烟;
(7)因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置.
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气为碱性气体,应选择碱性干燥剂碱石灰干燥,浓硫酸具有酸性能与氨气反应,不能干燥氯气;
故答案为:碱石灰; 不能;
(3)n(NH4Cl)=$\frac{10.7g}{53.5g/mol}$=0.2mol,根据反应方程式可知,n(NH3)=n(NH4Cl)=0.2mol,所以V(NH3)=n•Vm=0.2mol×22.4L/mol=4.48L;
故答案为:4.48;
(4)氨气密度小于空气,应采用向下排气法收集,故答案为:向下排空气法;
(5)氨气能使湿润的红色石蕊试纸变蓝,所以D中颜色发生变化,故答案为:D;蓝色;
(6)氨气与挥发的HCl会生成氯化铵晶体,所以有白烟生产,故答案为:有白烟生成;
(7)因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置,故答案为:F.
点评 本题考查了氨气的制备及氨气的性质,掌握制备原理及氨气的性质是解题关键,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 硒化氢比硫化氢稳定 | |
| B. | 原子序数为 34 | |
| C. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| D. | Se 的非金属性比 Br 弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰和碘分别变为气体 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②③④⑤ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 氚表示为:${\;}_{1}^{2}$D | |
| D. | 原子核内有l8个中子的氯原子:${\;}_{17}^{36}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 7.8g Na2O2固体中阴、阳离子总数为0.4NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| D. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.075 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R,金属性L>Q | |
| B. | M与T形成的化合物具有两性 | |
| C. | L2+与R2-的核外电子数相等 | |
| D. | L的原子半径最大,电负性最小,T的原子半径最小,电负性最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
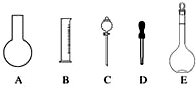 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com