
分析 反应2FeCl3+H2S═2FeCl2+S↓+2HCl中,Fe元素的化合价由+3价降低为+2价,得电子数为2×e-,S元素的化合价由-2价升高到0,以此解答该题.
解答 解:反应2FeCl3+H2S═2FeCl2+S↓+2HCl中,Fe元素的化合价由+3价降低为+2价,得电子数为2×e-,S元素的化合价由-2价升高到0,氧化剂为FeCl3,还原剂为H2S,氧化产物为S,还原产物为FeCl2,该反应改为离子反应时,H2S、S应保留化学式,则离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;FeCl3;H2S;S;FeCl2.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确元素的化合价及变化,得失电子的元素及离子方程式的书写方法即可解答,难度不大.


科目:高中化学 来源: 题型:解答题
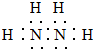 ,其中氮的化合价为-2价.
,其中氮的化合价为-2价.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
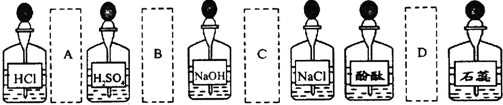
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)为置换反应 | B. | (2)为化合反应 | ||
| C. | 只有(1)(3)为氧化还原反应 | D. | (1)(2)(3)均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取剂要求不溶于水,且比水更容易使碘溶解 | |
| B. | 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后立即分液 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 实验室如果没有四氯化碳,可以用酒精代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
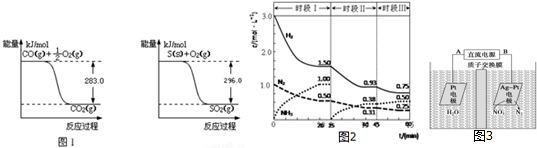
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com