
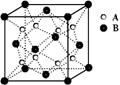
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,
在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
A.BA2 B.B2A C.B7A4 D.B4A7
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于硅单质及其化合物的说法正确的是
 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素
 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品
 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维
 ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
 A.①② B.②③ C.①④ D.③④
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类合理的是
A.碱性氧化物:Na2O CaO Mn2O7 MgO
B.碱:NaOH KOH Ba(OH)2 Na2CO3
C.铵盐:NH4Cl NH4NO3 (NH4)2SO4 NH3·H2O
D.氧化物:CO2 NO SO2 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4。则下列判断正确的是
A.元素电负性:按X、Y、Z变小
B.含氧酸的酸性:H3ZO4>H2YO4>HXO4
C.气态氢化物稳定性:按X、Y、Z顺序增加
D.非金属性:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是
A.HF、HCl、HBr、HI的热稳定依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次减小
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E、F六种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1。F+离子的3d轨道中电子全充满。回答下列问题:
(1)写出基态E原子的电子排布式──────────────── 。
(2)用电子式表示AE2的形成过程 。
(3)B、C两元素的第一电离能大小关系为:───>────(填写元素符号),原因是 。
(4)B元素的最低价氢化物分子立体构型为 。中心原子的杂化方式为 。
(5)向F2+离子的溶液中加入过量CH3的浓溶液,充分反应后溶液呈深蓝色,该反应的离子方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“纳米材料”(1 nm=10-9m )是指研究开发直径为几纳米至几十纳米的材料。如将“纳米材料”分散到某液体中,对于所得分散系的叙述不正确的是
A.光束通过此分散系时会形成一条光亮的“通路”
B.此分散系中“纳米材料”的粒子在做不停的、无序的运动
C.用滤纸过滤的方法可以从此分散系中分离得到该“纳米材料”
D.在外加电场作用下,“纳米材料”的粒子可能向某一极做定向运动
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)某溶液中只含有K+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,回答下列问题:
①该反应中的氧化剂是_______________。
②用单线桥表示此反应转移的电子数目及方向。
_______________________________________________
③若氧化产物比还原产物多1.75 mol,上述反应转移的电子数目为 。
(3)镁、铝合金3 g与100 mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4 g,则原硫酸溶液的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ 碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g)  WI2(g)
WI2(g)
为模拟上述反应,在实验室中准确称
 取0.508 g 碘、0.736 g金属钨放置于50.0
取0.508 g 碘、0.736 g金属钨放置于50.0
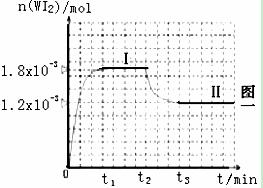
mL密闭容器中,并加热使其反应。右图一
是混合气体中的WI2蒸气的物质的量随时
间变化关系的图像[n(WI2) ~ t],其中
曲线Ⅰ(0~t2时间段)的反应温度为450℃,
曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
请回答下列问题:
(1)该反应是 (填写“放热”“吸热”)反应。
(2)反应从开始到t1(t1= 3 min)时间内的平均速率υ(I2)= mol/(L.min)。
(3)在450℃时,计算该反应的平衡常数K= 。
(4)能够说明上述反应已经达到平衡状态的有 。
A.I2与WI2的浓度相等
B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
 C.容器内混合气体的密度不再增加
C.容器内混合气体的密度不再增加
D.容器内气体压强不变化
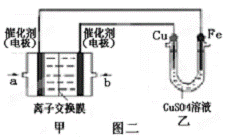
Ⅱ 图二中甲为甲醇燃料电池(电解质溶
液为KOH溶液),该同学想在乙中实
现铁上镀铜,则a处电极上发生的电
极反应式是 。
Ⅲ 已知:H2(g)、CO(g)和CH3CH2OH(l)的燃烧热
分别为285.8 kJ·mol-1、283.0 kJ·mol-1和1365.5 kJ·mol-1。
反应 2CO(g)+4H2(g) CH3CH2OH(l)+H2O(l) 的△H= 。
CH3CH2OH(l)+H2O(l) 的△H= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com