
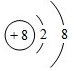 £®
£® £»ŗ¬ÓŠĄė×Ó¼üŗĶ¹²¼Ū¼üµÄ»ÆŗĻĪļµÄ»ÆѧŹ½ĪŖNa2O2£®
£»ŗ¬ÓŠĄė×Ó¼üŗĶ¹²¼Ū¼üµÄ»ÆŗĻĪļµÄ»ÆѧŹ½ĪŖNa2O2£® £®
£® ·ÖĪö ZŌ×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶£¬ZŌ×ÓÖ»ÄÜÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ŌņZĪŖOŌŖĖŲ£»YÓėXŠĪ³ÉµÄ·Ö×ÓÖŠÓŠ3øö¹²¼Ū¼ü£¬ĖÄÖÖŌŖĖŲ·Ö±šŹĒŌŖĖŲÖÜĘŚ±ķÖŠĮ¬Šų 3 øö¶ĢÖÜĘŚµÄŌŖĖŲ£¬YµÄŌ×ÓŠņŹżŠ”ÓŚOŌŖĖŲ£¬ŌņYĪŖNŌŖĖŲ”¢XĪŖHŌŖĖŲ£»WŌ×ÓµÄÖŹ×ÓŹżµČÓŚY”¢ZŌ×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶ£¬WŌ×ÓÖŹ×ÓŹż=5+6=11£¬ŌņWĪŖNaŌŖĖŲ£¬¾Ż“Ė½ųŠŠ½ā“š£®
½ā“š ½ā£ŗZŌ×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶£¬ZŌ×ÓÖ»ÄÜÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ŌņZĪŖOŌŖĖŲ£»YÓėXŠĪ³ÉµÄ·Ö×ÓÖŠÓŠ3øö¹²¼Ū¼ü£¬ĖÄÖÖŌŖĖŲ·Ö±šŹĒŌŖĖŲÖÜĘŚ±ķÖŠĮ¬Šų 3 øö¶ĢÖÜĘŚµÄŌŖĖŲ£¬YµÄŌ×ÓŠņŹżŠ”ÓŚOŌŖĖŲ£¬ŌņYĪŖNŌŖĖŲ”¢XĪŖHŌŖĖŲ£»WŌ×ÓµÄÖŹ×ÓŹżµČÓŚY”¢ZŌ×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶ£¬WŌ×ÓÖŹ×ÓŹż=5+6=11£¬ŌņWĪŖNaŌŖĖŲ£¬
£Ø1£©ZĪŖOŌŖĖŲ£¬ŃõĄė×ÓµÄŗĖµēŗÉŹżĪŖ8”¢ŗĖĶāµē×Ó×ÜŹżĪŖ10£¬ĘäĄė×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ£ŗ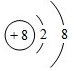 £¬
£¬
¹Ź“š°øĪŖ£ŗ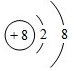 £ŗ
£ŗ
£Ø2£©ÓÉŅŌÉĻŌŖĖŲĮ½Į½ŠĪ³ÉµÄ»ÆŗĻĪļÖŠ£ŗČÜÓŚĖ®ĻŌ¼īŠŌµÄĘųĢ¬Ēā»ÆĪļŹĒ°±Ęų£¬°±ĘųµÄµē×ÓŹ½ĪŖ £»
£»
ŗ¬ÓŠĄė×Ó¼üŗĶ·Ē¼«ŠŌ¹²¼Ū¼üµÄ»ÆŗĻĪļĪŖ¹żŃõ»ÆÄĘ£¬¹żŃõ»ÆÄʵĻÆѧŹ½ĪŖ£ŗNa2O2£¬
¹Ź“š°øĪŖ£ŗ £»Na2O2£»
£»Na2O2£»
£Ø3£©ÓÉX”¢Y”¢ZĖłŠĪ³ÉµÄ³£¼ūĄė×Ó»ÆŗĻĪļŹĒNH4NO3£¬WµÄ×īøßŃõ»ÆĪļµÄĖ®»ÆĪļĪŖNaOH£¬¶žÕß·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗNH4++OH-$\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+H2O£¬
¹Ź“š°øĪŖ£ŗNH4NO3£»NH4++OH-$\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+H2O£»
£Ø4£©W2ZĪŖNa2O£¬Ńõ»ÆÄĘŹōÓŚĄė×Ó»ÆŗĻĪļ£¬ÓƵē×ÓŹ½±ķŹ¾Ńõ»ÆÄʵĊĪ³É¹ż³ĢĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾Ģāæ¼²éĪ»ÖĆ”¢½į¹¹ÓėŠŌÖŹ¹ŲĻµµÄ×ŪŗĻÓ¦ÓĆ£¬×ŪŗĻæ¼²éѧɜ·ÖĪöĪŹĢāµÄÄÜĮ¦£¬ĢāÄæÄѶČÖŠµČ£¬ÕżČ·ĶʶĻø÷ŌŖĖŲĆū³ĘĪŖ½ā“š¹Ų¼ü£¬±¾Ģā×¢Ņāµē×ÓŹ½µÄŹéŠ“ŅŌ¼°Ļą¹ŲĪļÖŹµÄŠŌÖŹ£¬ĪŖŅדķµć£®


 ÓÅѧĆūŹ¦ĆūĢāĻµĮŠ“š°ø
ÓÅѧĆūŹ¦ĆūĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū¢Ü¢Ż¢Ž | B£® | ¢Ł¢Ś¢Ū¢Ü¢Ż | C£® | ¢Ł¢Ś¢Ū¢Ü | D£® | ¢Ł¢Ś¢Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
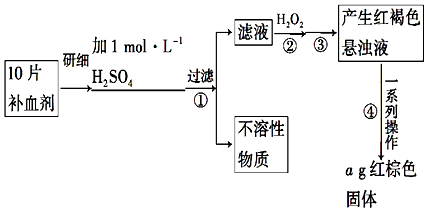
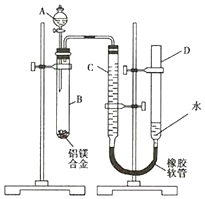 Ä³Ń§Ļ°Š”×éÓĆČēĶ¼×°ÖĆ²ā¶ØĆ¾ĀĮŗĻ½šÖŠĀĮµÄÖŹĮæ·ÖŹż£®
Ä³Ń§Ļ°Š”×éÓĆČēĶ¼×°ÖĆ²ā¶ØĆ¾ĀĮŗĻ½šÖŠĀĮµÄÖŹĮæ·ÖŹż£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĖįŹ½µĪ¶Ø¹ÜæÉŅŌÓĆĄ“×°ĖłÓŠµÄĖį»ņĖįŠŌČÜŅŗ | |
| B£® | ×ĘÉÕNa2CO3•10H2O ¾§ĢåŹ±Ó¦Ń”ÓĆÄĶøßĪĀµÄŹÆÓ¢ŪįŪö | |
| C£® | ŹµŃéŹŅÖĘČ”ŅŅĖįŅŅõ„Ź±ÓƱ„ŗĶNaHCO3ČÜŅŗŹÕ¼Æ²śĪļ | |
| D£® | ²ā¶ØČÜŅŗµÄpHŹ±£¬ŌŚ²£Į§°åÉĻ·ÅŅ»Ę¬øÉŌļµÄpHŹŌÖ½£¬ÓĆ²£Į§°ōÕŗȔȔ“żŹŌŅŗµĪµ½pHŹŌÖ½ÉĻ£¬°ŃŹŌÖ½Óė±ź×¼±ČÉ«æØ±Č½Ļ£¬¶Į³öČÜŅŗµÄpH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 Ņ»Ī»Ķ¬Ń§ĪŖĢ½¾æŌŖĖŲÖÜĘŚ±ķÖŠŌŖĖŲŠŌÖŹµÄµŻ±ä¹ęĀÉ£¬Éč¼ĘĮĖČēĻĀĮŠŹµŃ飮
Ņ»Ī»Ķ¬Ń§ĪŖĢ½¾æŌŖĖŲÖÜĘŚ±ķÖŠŌŖĖŲŠŌÖŹµÄµŻ±ä¹ęĀÉ£¬Éč¼ĘĮĖČēĻĀĮŠŹµŃ飮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĒāŃõ»ÆĶÓėĻ”ĮņĖį·“Ó¦£ŗOH-+H+ØTH2O | |
| B£® | Ģś·Ū¼ÓČėĻ”ĮņĖįÖŠ£ŗ2Fe+6H+ØT2Fe3++3H2”ü | |
| C£® | Ģ¼ĖįøĘÓė“×Ėį·“Ó¦£ŗCaCO3+2H+ØTCa2++CO2”ü+H2O | |
| D£® | ĀČ»ÆĀĮČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£ŗAl3++3NH3•H2OØTAl£ØOH£©3”ż+3NH${\;}_{4}^{+}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Zn | A | B | C | D |
| Õż¼« | Fe | C£ØŹÆÄ«£© | Ag | Zn |
| øŗ¼« | Cu | Fe | Fe | Fe |
| µē½āÖŹČÜŅŗ | FeCl3 | Fe2 £ØSO4£©3 | H2SO4 | FeCl3 |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1£ŗ2 | B£® | 3£ŗ1 | C£® | 3£ŗ2 | D£® | 4£ŗ3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com