
A、C+O2
| ||||
| B、CaCO3+2HCl=CaCl2+CO2↑+H2O | ||||
| C、2Na2O2+2H2O=4NaOH+O2↑ | ||||
| D、Zn+H2SO4=ZnSO4+H2↑ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
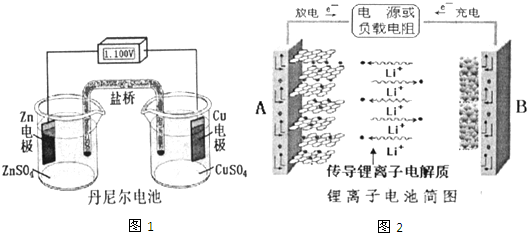
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、单质铜与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO
| ||||
B、向KAl(SO4)2溶液中逐滴滴加Ba(OH)2溶液至SO
| ||||
C、碳酸氢钠溶液与过量石灰水反应:2HCO
| ||||
| D、FeSO4溶液中加入H2O2:4Fe2++2H2O2+4H+=4Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.5mol?L-1CH3COOH溶液中所含CH3COO-个数为0.5NA |
| B、在Fe参与的反应中,1molFe失去的电子数为3NA |
| C、14g14N所含最外层电子数为5NA |
D、1 mol 分子中含碳碳双键数为3NA 分子中含碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅单质广泛用于光纤通讯 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、餐桌上的瓷盘是硅酸盐制品 |
| D、化学家采用玛瑙研砵磨擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15 mol/L |
| B、0.3 mol/L |
| C、0.45 mol/L |
| D、0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下c(OH-)/c(H+)=10-13的溶液中可能含有K+、Fe2+、NO3-、Cl-四种离子 |
| B、1 L 0.1 mol?L-1的CH3COONa溶液中CH3COO-和OH-的总数是0.1NA |
| C、将过量的二氧化碳通入漂白粉溶液中反应的离子方程式是:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
| D、称取25.0 g CuSO4?5H2O固体溶于75.0 mL水中,所得溶液中溶质的质量分数为16.0% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com