
【题目】一定温度下,某气态平衡体系的平衡常数表达式为K=![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A. 升高温度,平衡常数K一定增大
B. 增大A浓度,平衡向正反应方向移动
C. 增大压强,C体积分数增加
D. 升高温度,若B的百分含量减少,则正反应是放热反应
科目:高中化学 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
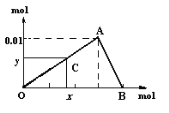
(1)OA曲线表示的离子反应是:__________________________;由此可得A点时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________,由此可得B点的坐标为:_______。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是

A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N。若向M、N溶液中逐滴加入浓度为0.25mol·L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B。
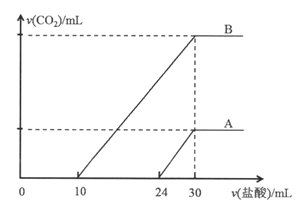
请回答下列问题:
(1)NaOH溶液的物质的量浓度为_____________。
(2)M、N两溶液中相同组分溶质的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应的限度的叙述,错误的是
A.化学反应的限度与时间的长短无关
B.化学反应达到限度时,正、逆反应速率相等
C.化学反应的限度是不可改变的
D.任何可逆反应都有一定的限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如右图所示。下列推理分析不合理的是( )
N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如右图所示。下列推理分析不合理的是( )
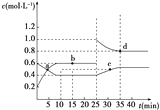
A. 前10 min内,用v(NO2)表示的反应速率为0.02 mol·L-1·min-1
B. 反应进行到10 min时,体系吸收的热量为9.68 kJ
C. b、d两点中v(正)与v(逆)均相等
D. 25 min时,正反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com