
| A. | 缩小容器的容积 | |
| B. | 保持容器的容积不变,通入稀有气体 | |
| C. | 保持容器内压强不变,通入稀有气体 | |
| D. | 及时把生成的NH3分离出去 |
分析 恒温条件下,达到平衡后,欲使正反应速率增大,可以通过增大反应物浓度、升高温度、增大压强、加入催化剂等方法实现.
解答 解:A.缩小容器容积,增大压强,增大单位体积内活化分子个数,正反应速率增大,故A正确;
B.保存容器的容积不变,通入稀有气体,反应物浓度不变,则正反应速率不变,平衡不移动,故B错误;
C.保持容器内压强不变,通入稀有气体,容器体积增大,反应物浓度降低,正反应速率减小,故C错误;
D.及时把氨气分离出去,生成物浓度减小,平衡正向移动,正反应速率减小,故D错误;
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,侧重考查学生分析判断能力,注意:改变压强时必须能引起反应物或生成物浓度改变的才能改变化学反应速率,否则不影响化学反应速率,注意比较BC选项区别,题目难度不大.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
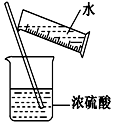 进行化学实验必须注意安全,下列说法中正确的组合是( )
进行化学实验必须注意安全,下列说法中正确的组合是( )| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
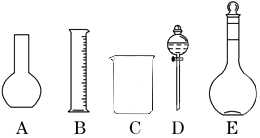
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
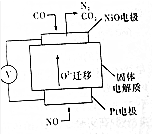
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
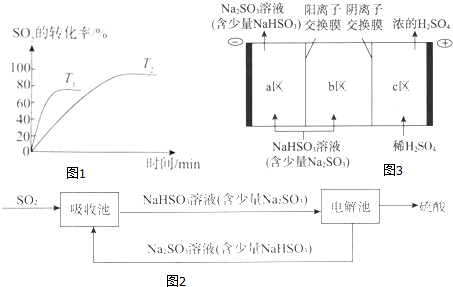
| 投料比 | a | b | c | d |
| SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p (Ne)>p (H2)>p (O2) | B. | p (O2)>p (Ne)>p (H2) | C. | p (H2)>p (O2)>p (Ne) | D. | p (H2)>p (Ne)>p (O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:4 | B. | 1:1:1 | C. | 4:2:1 | D. | 1:2:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com