
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol•L﹣1•s﹣1.
(2)n3 n4(填“>”、“<”或“=”),该反应的平衡常数为 (保留小数点后一位).
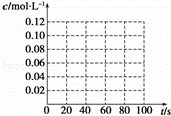
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是 mol•L﹣1,假设在80s时达到平衡,请在如图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)⇌Ν2O4(g)的平衡常数将 (填“增大”、“减小”或“不变”).
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”).
考点:
化学反应速率和化学计量数的关系;化学平衡常数的含义;化学平衡的影响因素;物质的量或浓度随时间的变化曲线.
专题:
化学平衡专题.
分析:
(1)根据反应速率表达式v= 计算出从反应开始直至20s时,二氧化氮的平均反应速率;
计算出从反应开始直至20s时,二氧化氮的平均反应速率;
(2)根据表中的数据可以判断60s时已经达到了平衡状态,据此进行判断n3和n4的大小;根据平衡常数的表达式及各组分的浓度计算出该反应的平衡常数;
(3)根据等效平衡,按照计算出将二氧化氮完全转化成四氧化二氮即可;根据二氧化氮和四氧化二氮及达到平衡时的浓度画出反应中N2O4和NO2的浓度随时间变化的曲线;
(4)根据升高温度,气体颜色会变深分析平衡移动方向及平衡常数的变化;
(5)根据稀有气体不影响各组分的浓度,容器容积增大,反应体系的仪器减小判断.
解答:
解:(1)从反应开始直至20s时,生成的四氧化二氮的物质的量为0.05mol,根据反应:2NO2⇌N2O4,消耗的二氧化氮物质的量为:0.1mol,二氧化氮的反应速率为:v(NO2)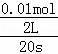 =0.0025mol•L﹣1•s﹣1,
=0.0025mol•L﹣1•s﹣1,
故答案为:0.0025;
(2)根据表中的数据可知,60s时反应达到了平衡状态,60s和80s时二氧化氮的物质的量相等,即n3=n4,
达到平衡状态时,n(N2O4)=0.08mol,n(NO2)=0.4mol﹣0.08mol×2=0.24mol,二者浓度分别为:c(N2O4)=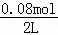 =0.04mol/L,c(NO2)=
=0.04mol/L,c(NO2)= =0.12mol/L,该该反应在该温度下的平衡常数为:
=0.12mol/L,该该反应在该温度下的平衡常数为: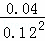 ≈2.8,
≈2.8,
故答案为:=;2.8;
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,说明两个反应为等效平衡,根据反应方程式,需要四氧化二氮的物质的量为:0.40mol×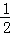 =0.20mol,c(N2O4)=
=0.20mol,c(N2O4)=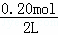 =0.10mol/L,
=0.10mol/L,
反应开始时,c(N2O4)=0.10mol/L,c(NO2)=0,之后二氧化氮浓度逐渐增加,四氧化二氮浓度逐渐减小,
达到平衡时,根据(2)可知,c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,据此画出反应中N2O4和NO2的浓度随时间变化的曲线为: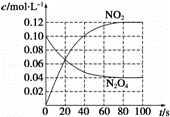
故答案为:0.10; ;
;
(4)由于升高温度,气体颜色会变深,说明化学平衡向着逆向移动,二氧化氮浓度增大,四氧化二氮浓度减小,所以平衡常数减小,
故答案为:减小;
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,稀有气体不影响各组分的浓度,由于把容器体积扩大为4L,反应体系的压强减小,平衡向着体积增大的方向移动,即向左移动,
故答案为:向左移动.
点评:
本题考查了化学反应速率与化学计量数的关系、化学平衡的影响因素、化学平衡常数的计算等知识,题目难度中等,涉及的知识点较多,充分考查了学生对所学知识的掌握情况及灵活应用能力.


科目:高中化学 来源: 题型:
Ⅰ实验室进行实验①制乙烯②制溴苯③石油分馏④银镜反应
(1)不需要加热的有 ;
(2)需要水浴的有 ;
(3)需要加碎瓷片的有 ;
(4)反应中必须加入浓H2SO4的有 ;(填序号)
Ⅱ现有:A.(CH3)3CCl;B.(CH3)3CCH2Cl;C.(CH3)2CHCl;D.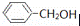 四种有机物
四种有机物
(1)能水解生成醇的是 ;(填字母)
(2)不能消去成烯的是 ;(填字母)
(3)D与甲酸发生酯化反应的产物是 .(写分子式)
查看答案和解析>>
科目:高中化学 来源: 题型:
目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列物质的分类不正确的是( )
|
| A. | SO2(氧化物) | B. | 碘酒(单质) | C. | HNO3(含氧酸) | D. | 氯水(混合物) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
|
| A. | HCl和NaOH反应的中和热△H=﹣57.3 kJ•mol﹣1,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ•mol﹣1 |
|
| B. | CO(g)的燃烧热是283.0 kJ•mol﹣1,则2CO2(g)═2CO(g)+O2(g)反应的△H=(2×283.0)kJ•mol﹣1 |
|
| C. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
|
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验的说法错误的是( )
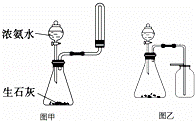
|
| A. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 |
|
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
|
| C. | 选择合适的试剂,用图乙所示装置可分别制取并收集少量CO2和O2 |
|
| D. | 实验室用图甲所示的装置制取少量氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用.下列实验中所选用的仪器合理的是( )
①用50mL量筒取5.2mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;③用托盘天平称量11.7g氯化钠晶体;
④用碱式滴定管取23.10mL溴水; ⑤用瓷坩埚灼烧各种钠的化合物;⑥用250mL容量瓶配制250mL 0.2mol/L的NaOH溶液.
A. ①②④ B. ②③④⑥ C. ③⑥ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
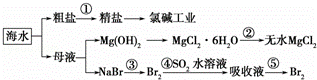
A. 除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D. 从第③步到第⑤步的目的是为了浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
过量的铜与浓硫酸在加热条件下的反应会因硫酸浓度下降而停止.为测定反应残余清液中硫酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量.
乙方案:与足量锌反应,测量生成氢气的体积.
回答下列问题:
(1)判定甲方案不可行,理由是 .
(2)甲同学用图1所示装置进行乙方案的实验.
①检查此装置气密性的方法
②使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中.残余清液与锌粒混合后的现象
③反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变.气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素).
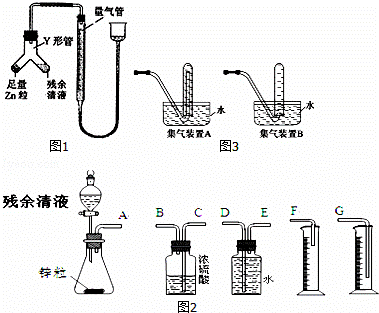
(3)乙同学拟选用图2实验装置完成实验:
①你认为最简易的装置其连接顺序是:A接 接 接 (填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后残余清液就不能顺利滴入锥形瓶.其原因是 .
③乙同学滴入锥形瓶中的残余清液体积为aml,测得量筒中水的体积为bml(假设体系中气体为标准状况),残余清液中硫酸的物质的量浓度的表达式 (用a、b表示)
④某学生想用排水法收集氢气,并检验其纯度,应选择图3集气装置 (填A或B)
查看答案和解析>>
科目:高中化学 来源: 题型:
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )

|
| A. | 正硼酸晶体中只存在氢键 |
|
| B. | H3BO3分子的稳定性与氢键无关 |
|
| C. | 分子中硼原子最外层为8e﹣稳定结构 |
|
| D. | 含1molH3BO3的晶体中有6mol氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com