
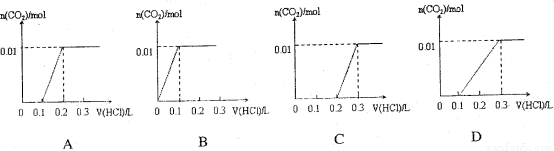
将0.4gNaOH和1.06gNa2CO3 混合并配成溶液,向溶液中滴加0.1mol·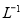 稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
科目:高中化学 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列混合物分离(或除杂)的方法正确的是( )
A.Na2CO3溶液中混有少量NaHCO3杂质可用通入足量CO2气体的方法提纯
B.Fe(OH)3中含有少量A1(O H)3可加入适量的HCl除去
H)3可加入适量的HCl除去
C.用CCl4可以从碘水中萃取碘
D.Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的硫酸除去
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期10月月考化学试卷(解析版) 题型:选择题
铋(Bi)位于元素周期表中第ⅤA族,其价态为+3价时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应实验现象如表所示:
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI?淀粉溶液 |
实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第一次月考化学试卷(解析版) 题型:选择题
在200 mL 含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5 mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图 所示。下列叙述不正确的是
所示。下列叙述不正确的是

 A.x-y=0. 01 mol B.原溶液中c(Cl-)=0.75 mol·L-1
A.x-y=0. 01 mol B.原溶液中c(Cl-)=0.75 mol·L-1
C.原溶液的pH=1 D.原溶液中n(Mg2+)∶n(Al3+)=5∶1
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第一次月考化学试卷(解析版) 题型:选择题
从矿物学资料查得一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法中正确的是
A.CuSO4是氧化剂,FeS2是还原剂 B.产物中的SO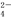 有一部分是氧化产物
有一部分是氧化产物
C.Cu2S既是氧化产物又是还原产物 D.5 mol FeS2发生反应,有10 mol e-转移
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A. 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B. 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
C. 氢氧化钠溶液吸收足量SO2气体:SO2 + 2OH-=SO32- + H2O
D. 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2—=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高三上第三次月考化学试卷(解析版) 题型:填空题
在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6 g。
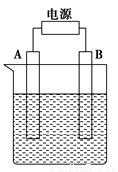
请回答下列问题;
(1)A接的是电源的________极,B是该装置______极
(2)写出电解时反应的总离子方程式_______________
(3)电解后溶液的pH为________;要使电解后溶液恢复到电解前的状态,则需加入________,其质量为________。(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上10月月考化学卷(解析版) 题型:选择题
1gO2和1gO3相比,下列表述正确的是
A.所含分子数相同 B.1gO3中所含分子数较多
C.所含原子数不同 D.所含原子数相同
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次考试化学试卷(解析版) 题型:填空题
达喜【AlaMgb(OH)c(CO3)d ·xH2O】常用于中和胃酸。

(1)1 mol达喜与足量的盐酸完全反应后生成水的物质的量为 mol(用含x等字母的代数式表示)。
(2)达喜化学式中a、b、c、d的关系为a+b c+d(填“>”、“=”或“<”)。
(3)已知在常温下溶液中Al3+、Mg2+、AlO2-的浓度与溶液pH的关系如上图所示。为测定达喜的组成,进行了下列实验:
① 取达喜6.02 g研碎,缓慢加入2.00 mol·L-1盐酸使其溶解,当加入盐酸85.00 mL时开始产生CO2,加入盐酸至90.00 mL时正好反应完全。
② 在①所得溶液中加入适量的 (填“氨水”、“氢氧化铝”或“氯化镁”)以调节溶液的pH至5.0~7.8,使有关离子完全沉淀。
③ 将②产生的全部沉淀过滤、洗涤,灼烧至恒重,称量为1.02 g。确定达喜的化学式为___________,并简要写出计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com