
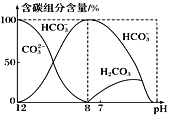
【题目】常温下在20mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法不正确的是
A.在同一溶液中,H2CO3、![]() 、
、![]() 不能大量共存
不能大量共存
B.测定混有少量氯化钠的碳酸钠的纯度,若用滴定法,指示剂可选用酚酞
C.当pH=7时,溶液中各种离子的物质的量浓度的大小关系: c(Na+)>c(Cl-)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
D.已知在25℃时,![]() 水解反应的平衡常数即水解常数Kh1 =2.0×10-4,溶液中c(
水解反应的平衡常数即水解常数Kh1 =2.0×10-4,溶液中c(![]() )∶c(
)∶c(![]() )=1∶1时,溶液的pH=10
)=1∶1时,溶液的pH=10
【答案】D
【解析】
A.根据图像分析,pH>8时只有碳酸根离子和碳酸氢根离子,pH=8时,只有碳酸氢根离子,pH<8时,溶液中只有碳酸和碳酸氢根离子,则在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故A正确;
B.Na2CO3溶液中逐滴加入HCl溶液,用酚酞作指示剂,滴定产物是![]() ,用甲基橙作指示剂滴定时,
,用甲基橙作指示剂滴定时,![]() 和HCl溶液的反应产物是H2CO3,故B正确;
和HCl溶液的反应产物是H2CO3,故B正确;
C.由图象可知,pH=7时,c(H+)=c(OH-),溶液中含碳元素的主要微粒为HCO3-、H2CO3,电荷守恒可知:c(Na+)+c(H+)=c(Cl)+c(HCO3-)+c(OH),则c(Na+)>c(Cl),因HCO3-水解,则c(Na+)>c(Cl)>c(HCO3-),溶液中各种离子的物质的量浓度的大小关系为c(Na+)>c(Cl)>c(HCO3-)>c(H+)=c(OH),故C正确;
D.已知在25℃时,溶液中c(![]() )∶c(
)∶c(![]() )=1∶1,
)=1∶1,![]() 水解反应的平衡常数即水解常数Kh1 =
水解反应的平衡常数即水解常数Kh1 =![]() c(OH-)=2.0×10-4,则c(H+)
c(OH-)=2.0×10-4,则c(H+)![]()
![]() =5.0×10-11,溶液的pH<10,故D错误;
=5.0×10-11,溶液的pH<10,故D错误;


科目:高中化学 来源: 题型:
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中 NaOH 的质量分数,进行如下步骤实验:
① 称量 1.0g 样品溶于水,配成 250 mL 溶液;
② 准确量取 25.00 mL 所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用 0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)称量1.0g 样品,除小烧杯、药匙外,所用到的主要仪器有_________。
(2)将样品配成 250 mL 溶液,除小烧杯、玻璃棒外,还需用到的玻璃仪器有_________。
(3)用_________滴定管(填“酸式”或“碱式”)盛装 0.10mol/L 的盐酸标准液。
(4)观察滴定到终点时溶液颜色的变化为_________。
(5)烧碱样品的纯度为_________。
(6)若出现下列情况,测定结果偏高的是_________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
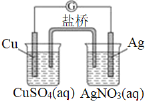
①铜电极的质量减少②正极反应为Ag++e-=Ag ③在外电路中,电流由铜电极流向银电极 ④实验过程中取出盐桥,原电池仍继续工作
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是从金银花中提取出的有很高药用价值的有机物,其结构如图所示,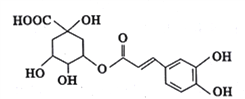
下列说法正确的是
A. 绿原酸的分子式为C16H20O9
B. 绿原酸分子中有4种含氧官能团
C. l mol绿原酸与NaOH溶液反应,可消耗7 mol NaOH
D. 绿原酸在酸性条件下的水解产物均能与NaHCO3发生反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是
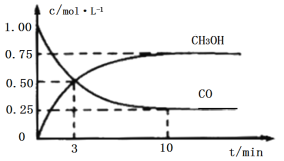
A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO)=0.075mol/(L·min1)
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液的pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法错误的是

A. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-)
B. 水的电离程度:a点小于c点
C. 原 NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol·L-1
D. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是___________价,其基态原子电子排布式为___________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4,溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是___________。
②除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为___________。
③NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为___________。但NF3不易与Cu2+形成化学键,其原因是___________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。
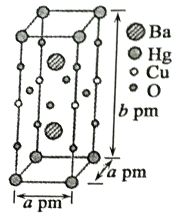
①该物质的化学式为___________。
②已知该晶胞中两个Ba2+的间距为cpm。则距离Ba2+最近的Hg+数目为___________个,二者的最短距离为___________pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的主要反应及能量变化如图:

回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,该反应必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)___(填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是_______。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强p1、p2分别为1×104 Pa和1×105 Pa)。
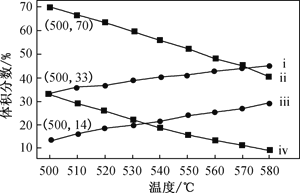
①1×104 Pa时,如图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为____。
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是__________。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0kJ/mol、△H =-285.8kJ/mol。
①反应(ⅰ)的化学方程式为_____。
②25℃时,该工艺总反应的热化学方程式为________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com